Concentração de proteínas de [i]Spirulina platensis[/i] utilizando ultrafiltração
ISBN 978-85-85905-25-5
Área
Alimentos
Autores
Menegotto, A.L.L. (URI - ERECHIM) ; Duarte, J. (UNIVERSIDADE DE CAXIAS DO SUL) ; Andrade, M.Z. (UNIVERSIDADE DE CAXIAS DO SUL) ; Fernandes, I.A. (URI - ERECHIM) ; Steffens, J. (URI - ERECHIM) ; Valduga, E. (URI - ERECHIM)
Resumo
A elevada composição de proteínas de S. platensis torna esta microalga um promissor componente nos alimentos. Afim de garantir a qualidade das proteínas, processos de separação por membranas vêm sendo amplamente aplicados. O objetivo deste estudo foi avaliar a ultrafiltração associada à diafiltrações (UF/DF) para concentração de proteínas de S. platensis. A aplicação de UF/DF utilizando membrana de fibra oca (50 kDa e fluxo tangencial), pressão de 1,5 bar, 30°C e fator de concentração de 1,39, possibilitou a obtenção de um isolado proteico com aproximadamente 88% de proteínas, coloração verde-azulada e com concentração de ficocianina de 142 mg/L. A UF/DF apresentou potencial para concentração de proteínas de S. platensis, com capacidade de aplicação industrial.
Palavras chaves
ficocianina; isolado proteico; separação por membranas
Introdução
A composição das microalgas varia entre 7 a 23% de lipídios, 5 a 23% de carboidratos e 6 a 52% de proteínas, de acordo com a espécie e com seu meio de cultivo (ROMERO GARCÍA; ACIÉN FERNÁNDEZ; FERNÁNDEZ SEVILLA, 2012). Desta forma, é possível verificar que as microalgas podem apresentar elevada concentração de proteínas, sendo que a Spirulina é uma das microalgas que contém maiores percentuais deste componente, correspondendo entre 55,8 a 77% de seu peso seco (BARKA; BLECKER, 2016). As proteínas da S. platensis possuem alto valor nutricional (LUPATINI et al., 2017b), podendo ser comparada a fontes proteicas vegetais e animais. Estas proteínas, também, possuem potencial para compor formulações de alimentos, aprimorando os processos tecnológicos, devido suas apreciáveis propriedades funcionais, tais como propriedades espumantes, emulsificantes e gelificantes (MENEGOTTO et al, 2019; BENELHADJ et al., 2016). Além disso, a S. platensis contém percentuais de ficobiliproteínas, destacando-se a ficocianina, um pigmento de coloração verde-azulada (LUPATINI et al., 2017b), que corresponde a aproximadamente 20% das proteínas desta microalga (SU et al., 2014). Desta forma, além do estudo de técnicas de extração de proteínas de S. platensis, envolvendo o rompimento celular e exposição dos componentes ao meio (SAFI et al., 2014), o aprimoramento de métodos de recuperação e/ou purificação são de grande importância. Na literatura, poucos são os estudos de purificação de proteínas de microalgas, entre as técnicas para este fim, as mais relatadas vêm sendo tratamentos enzimáticos e os métodos de precipitação cromatográficos (PONTIS, 2016; BARBA; GRIMI; VOROBIEV, 2015; AMID; ABDUL MANAP; MUSTAFA, 2013; NAGARAJ; PATIL; BIRADAR, 2006). O processo de separação por membrana (PSM) torna-se um método alternativo, aos processos convencionais de separação e purificação, onde a ultrafiltração (UF) tem sido indicada como estratégia para resolver problemas de precipitação isoelétrica de proteínas (MONDOR, 2014). Contudo, o uso de PSM para recuperar e purificar proteínas de microalgas ainda é pouco relatado cientificamente. Além disso, a associação de UF com diafiltração (DF) pode ser essencial para aumentar o desempenho de processos de purificação de proteínas (ABEL et al., 2018). A partir destas evidências, este trabalho teve como objetivo avaliar a associação de UF/DF, visando à separação e concentração das proteínas de S. platensis, bem como, a caracterização parcial das frações por análise de proteínas totais, concentração de ficocianina e índices de cor.
Material e métodos
A biomassa de S. platensis foi obtida comercialmente da Fazenda Tamandúa (Santa Terezinha, Paraíba). A extração proteica foi realizada conforme Lupatini et al. (2017a) e adaptações. A biomassa foi suspendida em água purificada (30 g/L) e o pH foi ajustado com NaOH 0,1 M para 9,0. A suspensão foi submetida ao tratamento ultrassônico em banho de ultrassom (Unique, USC-1800A, Indaiatuba) na frequência de 40 kHz, amplitude de 90% por 35 min e, em seguida à agitação mecânica (Fisatom, 712, São Paulo) na velocidade de 100 rpm por 50 min. Para separação das fases realizou-se a centrifugação à 7000 rpm, 25ºC por 15 min (Biosystems, MPW-351R, Curitiba). O extrato proteico de S. platensis (EPSp), obtido a partir do sobrenadante coletado na etapa de extração foi submetido a uma filtração convencional (papel filtro qualitativo 60x60 cm, gramatura 80 g) e, em seguida aos ensaios de UF/DF. Primeiramente, realizou-se a UF com membrana de poliétersulfona (847, PAM- Membranas, Rio de Janeiro), tipo fibra oca com tamanhos de poros assimétricos de corte de 50 kDa, área de filtração de 0,027 m2, fluxo tangencial, pressão de 1,5 bar e 30ºC. Em seguida, a DF foi associada ao processo; considerando o fator de concentração de 1,39, o qual foi calculado de acordo com Atra et al. (2015). Adicionando-se água ao concentrado obtido pela UF, o qual foi novamente filtrado; foram realizadas três subsequentes lavagens, com água purificada, das frações concentradas (DF1, DF2 e DF3). O volume de água adicionada foi proporcional para completar o volume inicial de EPSp (500 mL). O processo foi realizado em batelada por aproximadamente 0,7 h. O fluxo de permeado foi monitorado a cada 5 min e calculado de acordo com Cuartas-Uribe et al. (2007). A composição de proteínas foi determinada pela quantificação de nitrogênio pelo método de oxidação por combustão catalítica a 720ºC com detecção por infravermelho (Shimadzu, TOC-VCSH, Japão), considerando-se o 6,25 como fator de conversão de nitrogênio em proteína. Os resultados de proteínas foram expressados em base seca (bs); a umidade das amostras foi determinada conforme AOAC (1998). A determinação da ficocianina consistiu na leitura de absorbância (Agilent Technologies, 8453E, EUA) a 615 e 652 nm, conforme Bennet e Bogorad (1973). Os índices de cor (L*, a* e b*) foram determinados por medida instrumental utilizando o colorímetro Minolta (Chroma Meter, CR400, Japão), expressos no sistema de cor CIELAB (Commission International for Ilumination). Os resultados foram tratados estatisticamente pela análise de variância (ANOVA) seguido da comparação entre as médias (teste de Tukey) com 95 % de nível de confiança, utilizando o programa Statistica 5.0 (Statsoft Inc., EUA). Para os ajustes dos dados experimentais e elaboração dos gráficos foi utilizado o programa OriginPro 7.0 (OriginLab Corporation, EUA).
Resultado e discussão
A Figura 1 apresenta os fluxos de permeados das DFs. Observa-se que houve uma
redução do fluxo com o tempo de operação da DF, onde para as DFs 2 e 3, a
partir de 0,4 h há uma tendência de estabilização do fluxo, coerente com os
fenômenos de polarização e incrustação da membrana (FERRER et al., 2014; LIU et
al., 2017). Na Tabela 1 são apresentados os resultados de proteínas totais,
ficocianina e índices de cor (L, a*, b*) das amostras do EPSp e dos
concentrados e permeados obtidos de acordo com o processo de UF/DF. A DF1 C
permitiu maior recuperação de proteínas, obtendo-se um teor de aproximadamente
88%, desta forma, o produto pode ser classificado como isolado proteico de
S. platensis, pois de acordo com a legislação brasileira para produtos
proteicos de origem vegetal, valores de proteína (bs) superiores a 88% são
caracterizados como isolados proteicos (BRASIL, 2005). Nas DFs seguintes, houve
uma redução da recuperação de proteína no concentrado, ocasionando um aumento
do teor de proteína nas frações permeadas. Isto pode estar associado a
possibilidade de as glicoproteínas formarem uma ligação covalente com os
polissacarídeos (SAFI et al., 2017). Como a maioria das proteínas de S.
platensis apresentam tamanho entre de aproximadamente 20 kDa (CHRONAKIS;
GALATANU; NYLANDER, 2000). A maior concentração de ficocianina (142,04 mg/L)
foi obtida na DF1 C. Isto ocorreu devido a massa molecular correspondente da
ficocianina, que de acordo com Viskari e Colyer (2002) é de 232 kDa, ou seja,
superior ao ponto de corte da membrana utilizada (50 kDa). A ficocianina é uma
ficobiliproteína com capacidade de coloração, presente na S. platensis,
a qual é composta por dois grupos de proteínas e pela ficocianibilina (grupo
cromóforo da ficocianina) (FUKUI et al., 2003). Os índices de cor apresentaram
diferença significativa (p<0,05) nos processos de UF e DF. Os resultados de L*
dos permeados foram maiores que os dos concentrados, mostrando maior
transparência e luminosidade. Para o índice a* os valores negativos dos
permeados indicam uma tendência de diminuição da cor esverdeada e nos
concentrados coloração avermelhada, diminuindo (p<0,05) com as DFs. Em relação
ao índice b* é possível verificar que os resultados para os permeados
apresentaram valores positivos, indicando a presença de coloração amarela e
concentrados, revelando a presença de cor azulada (b* negativo), em ambas as
frações diminuindo (p<0,05) com as DFs. Conforme os resultados colorimétricos,
é possível relacionar com a concentração de ficocianina, onde na DF1 C ocorreu
a maior concentração do pigmento, e consequentemente maior índice de a*.
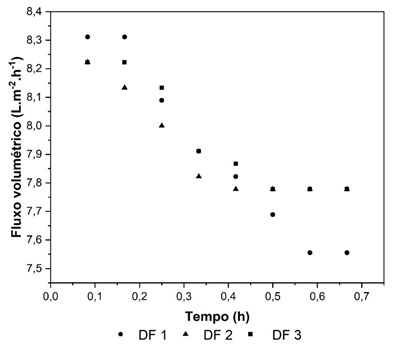
Figura 1. Fluxo de permeado das três subsequentes DFs adicionadas ao processo de UF para concentração de proteínas.
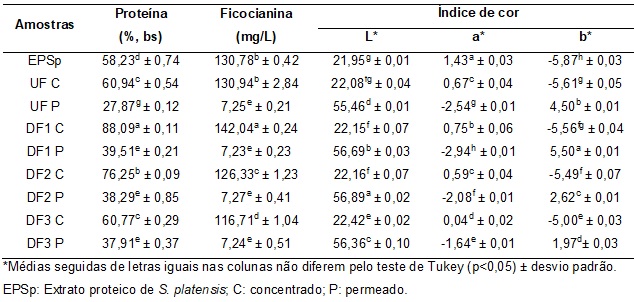
Tabela 1. Proteínas totais, ficocianina e índices de cor (L*, a*, b*) das amostras do EPSp, dos concentrados e permeados obtidos na UF/DF.
Conclusões
O processo de separação por membranas é uma tecnologia promissora para a purificação e/ou fracionamento de proteínas de S. platensis. Ao associar a membrana de UF/DF (fator de concentração de 1,39) foi possível obter de um isolado proteico de coloração verde-azulada, com 88% de proteínas (bs) e 142 mg/L de ficocianina. Os resultados são promissores, indicando a possibilidade em obter-se um isolado proteico com potencial de aplicação industrial.
Agradecimentos
Os autores agradecem a CAPES, CNPq, FAPERGS e URI pela concessão de bolsas de estudo e/ou apoio financeiro.
Referências
ABEL, J.; KOSKY, A.; BALL, N.; BACON, H.; KAUSHILK, R.; KLEEMANN, G. R. A small-scale process for predictiong donnan and volume exclusion effects during ultrafiltration/diafiltration process development. Jornal of Pharmaceutical Sciences, v. 107, p. 1296–1303, 2018. AOAC. Official methods of analysis of AOAC international. 16 ed. Estados Unidos: AOAC International, 1998. AMID, M.; ABDUL MANAP, M. Y.; MUSTAFA, S. Purification of pectinase from mango (Mangifera indica L. cv. Chokanan) waste using an aqueous organic phase system: A potential low cost source of the enzyme. Journal of Chromatography B: Analytical Technologies in the Biomedical and Life Sciences, v. 931, p. 17–22, 2013. ATRA, R.; VATAI, G.; BEKASSY-MOLNAR, E.; BALINT, A. Investigation of ultra- and nanofiltration for utilization of whey protein and lactose. Journal of Food Engineering, v. 67, p. 325–332, 2005. BARBA, F. J.; GRIMI, N.; VOROBIEV, E. Evaluating the potential of cell disruption technologies for green selective extraction of antioxidant compounds from Stevia rebaudiana Bertoni leaves. Journal of Food Engineering, v. 149, p. 222–228, 2015. BARKA, A.; BLECKER, C. Microalgae as a potential source of single-cell proteins. A review. Biotechnologie, Agronomie, Société et Environnement, v. 20, p. 427–436, 2016. BENELHADJ, S.; GHARSALLAOUI, A.; DEGRAEVE, P.; ATTIA, H.; GHORBEL, D. Effects of pH on the functional properties of Arthrospira (Spirulina) platensis protein isolate. Food Chemistry, v. 196, p. 1056-1063, 2016. BENNET, A.; BOGORAD, L. Complementary chromatic adaptation in a filamentous blue-green alga. The Journal of Cell Biology, v. 58, p. 419–485, 1973. BRASIL. Resolução RDC no 268, de 22 de setembro de 2005. Regulamento técnico para produtos protéicos de origem vegetal. Agência Nacional de Vigilância Sanitária. Disponível em < http://portal.anvisa.gov.br/documents/33880/2568070/RDC_268_2005.pdf/60145a2f-eb4c-4911-b1e0-46d776357a25 >. Acesso em: 27 mar. 2018. CHRONAKIS, I. S.; GALATANU, A. N.; NYLANDER, T. The behaviour of protein preparations from blue-green algae (Spirulina platensis strain Pacifica) at the air / water interface. Colloids and Surfaces A: Physicochemical and Engineering Aspects, v. 173, p. 181–192, 2000. CUARTAS-URIBE, B.; ALCAINA-MIRANDA, M. I.; SORIANO-COSTA, E.; BES-PIA, A. Comparison of the behavior of two nanofiltration membranes for sweet whey demineralization. Journal of Dairy Science, v. 90, p. 1094–1101, 2007. FERRER, M.; ALEXANDER, M.; CORREDIG, M. Changes in the physico-chemical properties of casein micelles during ultrafiltration combined with diafiltration. LWT – Food Science and Technology, v. 59, p. 173–180, 2014. FUKUI, K.; SAITO, T.; NOGUCH, Y.; KODERA, Y.; MATSUSHIMA, A.; NICHIMURA, H.; INADA, Y. Relationship between color development and protein conformation in the phycocyanin molecule. Dyes and Pigments, v. 63, p. 89–94, 2003. LIU, D.; Li, J.; Zhang, J.; LIU, X.; WANG, M.; HEMAR, Y.; REGENSTEIN, J. M.; ZHOU, P. Effect of partial acidification on the ultrafiltration and diafiltration of skim milk: Physico-chemical properties of the resulting milk protein concentrates. Journal of Food Engineering, v. 212, p. 55–64, 2017. LUPATINI, A, L.; BISPO, L. O.; COLLA, L. M.; COSTA, J. A. V.; CANAN, C.; COLLA, E. Protein and carbohydrate extraction from S. platensis biomass by ultrasound and mechanical agitation. Food Research International, v. 99, p.1028–1035, 2017a. LUPATINI, A. L.; COLLA, L. M.; CANAN, C.; COLLA, E. Potential application of microalgae Spirulina platensis as a protein source. Journal of the Science of Food and Agriculture, v. 97, p. 724–732, 2017b. MENEGOTTO et al.; SOUZA, L. E. S.; COLLA, L. M.; COSTA, J. A. V.; SEHN, E.; BITTENCOURT, P. R. S.; FLORES, E. L. M.; CANAN, C.; COLLA, E. Investigation of techno-functional and physicochemical properties of Spirulina platensis protein concentrate for food enrichment. LWT – Food Science and Technology, v. 114, 108267, 2019. MONDOR, M. Production of value-added soy protein products by membrane-based operations. In: CASSANO, A.; DRIOLI, E. (eds), Integrated Membrane Operations. Berlin/Boston: Walter de Gruyter GmbH, 2014. NAGARAJ, N.; PATIL, B. S.; BIRADAR, P. M. Osmotic membrane distillation - A brief review. International Journal of Food Engineering, v. 2, p. 1–22, 2006. PONTIS, H. G. Methods for analysis of carbohydrate metabolism in photosynthetic organisms. Plants, green algae, and cyanobacteria. London: Elsevier Inc., 2016. ROMERO GARCÍA, J. M.; ACIÉN FERNÁNDEZ, F. G.; FERNÁNDEZ SEVILLA, J. M. Development of a process for the production of L-amino-acids concentrates from microalgae by enzymatic hydrolysis. Bioresource technology, v. 112, p. 164–70, 2012. SAFI, C.; URSU, A. V.; LAROCHE, C.; ZEBIB, B.; MERAH, O.; PONTALIER, P.-Y.; VACA-GARCIA, C. Aqueous extraction of proteins from microalgae: Effect of different cell disruption methods. Algal Research, v. 3, p. 61–65, 2014. SAFI, C.; OLIVIERI, G.; CAMPOS, R. P.; ENGELEN-SMIT, N.; MULDER, W. J.; VAN DEN BROEK, L. A. M.; SIJTSMA, L. Biorefinery of microalgal soluble proteins by sequential processing and membrane filtration. Bioresource Technology, v. 225, p. 151–158, 2017. SU, C. H.; LIU, C. S.; YANG, P. C.; SYU, K. S.; CHIUH, C. C. Solid-liquid extraction of phycocyanin from Spirulina platensis: Kinetic modeling of influencial factors. Separation and Purification Technology, v. 123, p. 64-68, 2014. VISKARI, P. J.; COLYER, C. L. Separation and quantification of phycobiliproteins using phytic acid in capillary electrophoresis with laser-induced fluorescence detection. Journal of Chromatography, v. 972, p. 269–276, 2002.









