OXIDAÇÕES DE SUBSTÂNCIAS ORGÂNICAS USANDO UM NOVO AQUACOMPLEXO DIARSÍNICO DE RUTÊNIO (II) COMO ELETROCATALISADOR
ISBN 978-85-85905-25-5
Área
Química Orgânica
Autores
Batalini, C. (UFMT/CUA - LAPQUÍM - PONTAL DO ARAGUAIA (MT)) ; de Giovani, W.F. (FFCLRP/USP/RIBEIRÃO PRETO (SP))
Resumo
Ressalta-se aqui o emprego de um novo aquacomplexo tripiridínico de rutênio (II) contendo um ligante diarsínico como eletrocatalisador, em oxidações eletroquímicas de diferentes substâncias orgânicas: [Ru(L)(totpy) (OH2)] (ClO4)2 (L=Ph2AsCH2CH2AsPh2); (totpy=4´- (4-toluil)-2,2´:6´,2´´-tripiridina). As eletro-oxidações foram conduzidas sob potencial constante de +1,00 V (vs ECS), em solução 7:3 tampão fosfato:metilpropan-2-ol, pH 8,1. Os substratos orgânicos e os respectivos produtos obtidos foram: álcool benzílico (benzaldeído), benzaldeído (ácido benzóico), éter benzílico e butílico (benzaldeído e ácido benzóico) e 1-feniletanol (acetofenona). Foram observadas reações seletivas e com bons rendimentos para os produtos.
Palavras chaves
Complexo de rutênio; Eletrocatálise; Eletro-oxidação
Introdução
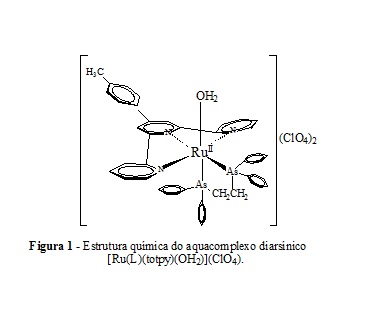
Uma extensa variedade de substâncias orgânicas podem sofrer oxidações por métodos clássicos, envolvendo oxidantes inorgânicos, via oxidantes biológicos ou através de processos eletroquímicos. Essa última estratégia apresenta algumas vantagens como rapidez, a possibilidade de utilizar meio aquoso nas reações, a seletividade na formação dos produtos e a necessidade de pequena escala de catalisador. Ligantes tripiridínicos como 2,2’:6’,2’’- tripiridina e seus derivados substituídos são frequentemente empregados na preparação de complexos de rutênio, proporcionando uma alta estabilidade ao complexo com relação à perda destes ligantes (TSE et al., p. 987, 2005; EZHILARASU et al., p. 265, 2017). Verifica-se ainda que ligantes bidentados diarsínicos e difosfínicos oferecem algumas vantagens sobre seus análogos monodentados por fornecer melhor controle sobre o número de coordenação e estereoquímica do complexo resultante e por diminuir processos de troca intra- e intermoleculares (GAO et al., p. 1241, 1996). Alguns estudos eletrocatalíticos sistemáticos realizados no grupo de pesquisa frente à substratos orgânicos, têm mostrado que sistemas aqua/oxocomplexos polipiridínicos de rutênio mistos com fosfinas ou arsinas, foram mais seletivos do que aqueles contendo apenas polipiridinas como ligantes (LIMA et al., p. 313, 1998; SUSSUCHI et al., p. 302, 2006). Propôs-se, dessa maneira, testar a capacidade eletrocatalítica de um aquacomplexo tripiridínico de rutênio contendo uma combinação inédita com um ligante bidentado diarsínico (figura 1): [Ru(L)(totpy)(OH2)] (ClO4)2 (L=Ph2AsCH2CH2AsPh2); (totpy=4´- (4-toluil)-2,2´:6´,2´´-tripiridina), em experimentos de eletro-oxidação de substâncias orgânicas com diferentes funções, em fase aquosa homogênea.
Material e métodos
A síntese total do aquacomplexo diarsínico [Ru(L)(totpy)(OH2)] (ClO4)2, com uma combinação inédita de um ligante tripiridínico substituído (totpy) e um ligante bidentado de arsina (L) envolveu três etapas a partir do complexo [Ru(OH2)3Cl3] e encontra-se referenciado na literatura (BATALINI & De GIOVANI, p. 130, 2019). Os estudos eletroquímicos foram realizados em aparelho potenciostato/galvanostato FAC-200 A. Para os experimentos de eletro-oxidação foi usada uma célula eletroquímica de dois compartimentos, contendo calomelano saturado como eletrodo de referência, placa de platina (área 1,00 cm2, espessura 0,20 cm) como eletrodo auxiliar, dentro de um tubo de vidro sinterizado. Como eletrodo de trabalho usou-se uma rede de platina de 164,00 cm2 de área e diâmetro do fio 0,16 mm. As eletro-oxidações foram realizadas à temperatura e pressão ambientes, em solução tampão fosfato:metilpropan-2-ol 7:3, pH 8,1. A relação das concentrações foi de 1,00 mmol.L-1 do aquacomplexo diarsínico [Ru(L)(totpy)(OH2)](ClO4) 2 para 50,00 mmol.L-1 dos substratos orgânicos. Ao término de cada eletro-oxidação, o pH da solução foi elevado para aproximadamente 10 adicionando solução aquosa de 1,00 mol.L-1 de hidróxido de sódio (NaOH) e a fase orgânica foi extraída cinco vezes com porções de 5 mL de éter dietílico. Para os experimentos que levam ao ácido benzoico (ou como produto da reação de oxidação ou como subproduto), a fase aquosa restante foi acidificada com ácido clorídrico concentrado até pH em torno de 2,0 e nova extração com éter dietílico foi realizada. Após evaporação do solvente, identificou-se os produtos e calculou-se o rendimento das reações através de cromatografia gasosa, empregando quantidade conhecida de cicloexanol como padrão interno, ou pesagem do material, ponto de fusão e/ou RMN1H.
Resultado e discussão
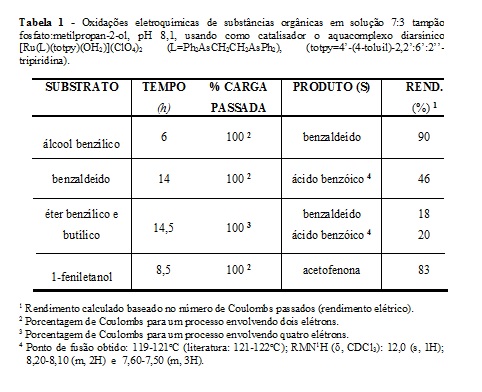
Os experimentos de oxidação eletroquímica de substâncias orgânicas de
diferentes funções são descritos na tabela 1. O potencial aplicado escolhido
foi +1,00 V (vs ECS) para todas as eletro-oxidações, suficiente para gerar o
oxocomplexo a partir do aquacomplexo. Os resultados da tabela 1 indicam
reações que se apresentaram seletivas na formação de um único produto. Essa
seletividade é particularmente evidenciada nas oxidações do álcool benzílico
e 1-feniletanol, onde não foram observados a formação de ácido benzóico no
processo. Nesses dois experimentos, parece existir um controle que
justifique essa não formação de ácido benzóico, tendo em vista que, nas
mesmas condições de reação, benzaldeído foi oxidado ao ácido benzóico.
Assim, a seletividade observada parece ser uma combinação do controle do
número de Coulombs passados na reação com o excesso de substrato durante a
oxidação, sendo preferencialmente oxidado pelo oxocomplexo, ao invés do
produto vir a sofrer oxidação posterior. Os dados obtidos em algumas
eletro-oxidações de substratos orgânicos, nas mesmas condições dos resultados
apresentados na tabela 1, em ausência do aquacomplexo [Ru(L)(totpy)
(OH2)]
(ClO4)2, também foram explorados e observamos que
praticamente não há
oxidação dos substratos orgânicos sem a presença do aquacomplexo de rutênio
sintetizado como catalisador. Percebe-se claramente a importância que o
sistema aqua/oxocomplexo de rutênio utilizado desempenha no processo de
transferência eletrônica, levando à formação dos produtos com rendimentos
bem mais acentuados e seletividade na formação de um único produto, em
potenciais menores que o necessário para a oxidação direta do substrato pelo
eletrodo.
Conclusões
Este trabalho demonstra a importância de se utilizar complexos metálicos como sistemas eletrocatalíticos em reações orgânicas. As quatro substâncias orgânicas sofreram oxidação seletiva frente ao novo aquacomplexo diarsínico empregado, em fase aquosa homogênea. Os rendimentos das eletro-oxidações variaram de bons a excelentes. Além das vantagens encontradas no processo, a utilização de oxidações eletroquímicas num sistema aquoso como o empregado nesta pesquisa, encontra-se na direção de uma química menos agressiva ao meio ambiente.
Agradecimentos
À CAPES, USP e UFMT pelo suporte científico.
Referências
BATALINI, C.; De GIOVANI, W. F. Periódico Tchê Química, v. 16, n. 32, p. 130, 2019.
EZHILARASU, T.; SATHIYASEELAN, A.; KALAICHELVAN, P. T.; BALASUBRAMANIAN, S. Journal of Molecular Structure, v. 1134, p. 265, 2017.
GAO, J. X; WAN, H. L.; WONG, W. K.; TSE, M. C.; WONG, W. T. Polyhedron, v. 15, n. 8, p. 1241, 1996.
LIMA, E. C.; FENGA, P. G.; ROMERO, J. R.; De GIOVANI, W. F. Polyhedron, v. 17, p. 313, 1998.
SUSSUCHI, E. M.; LIMA, A. A.; GIOVANI, W. F. Journal of Chemical Catalysis A, Chemical, v. 259, p. 302, 2006.
TSE, M. K.; KLAWONN, M.; BHOR, S.; DOEBLER, C.; ANILKUMAR, G.; HUGL, H.; MAEGERLEIN, W.; BELLER, M. Organic Letters, v. 7, n. 6, p. 987, 2005.









