Síntese de arilóxi-benzoquinonas como candidatos a agentes antiparasitários
ISBN 978-85-85905-25-5
Área
Química Orgânica
Autores
Rodrigues, S.C. (UFF) ; Martins, M.T.M. (UFF) ; Cordeiro, B.M. (UFF) ; Dias, F.R.F. (UFF) ; Campos, V.R. (UFF) ; Cunha, A.C. (UFF)
Resumo
A doença de Chagas, infecção humana causada pelo protozoário Trypanosoma cruzi, é uma das principais endemias parasitárias da América Latina. Apesar de haver dois fármacos usados clinicamente no tratamento de pacientes chagásicos no mundo, o benznidazol e nifurtimox, apenas o primeiro é autorizado pela Agência Nacional de Vigilância Sanitária para comercialização no Brasil, devido à alta toxicidade do segundo medicamento. Assim, há necessidade da busca por novas substâncias mais eficazes e com menores efeitos colaterais para o paciente. Neste trabalho, quatro novos derivados de arilóxi-benzoquinonas foram sintetizados e tiveram suas estruturadas determinadas através de técnicas espectroscópicas de RMN de 1H e 13C, com prospecção da avaliação de suas atividades antiparasitárias.
Palavras chaves
Trypanosoma cruzi; Quinonas; Antiparasitários
Introdução
A doença de Chagas, também conhecida como tripanossomíase americana, é uma infecção causada pelo protozoário Trypanosoma cruzi que acomete milhões de pessoas no mundo. Apresenta uma fase aguda que pode ser assintomática e uma fase crônica podendo se manifestar nas formas indeterminada, cardíaca e digestiva (BERMUDEZet al, p.1, 2016). Mais de 100 anos depois da descoberta dessa enfermidade pelo brasileiro Carlos Chagas sem a existência de um medicamento que seja eficaz para o tratamento da doença na fase crônica. O único fármaco disponível no Brasil para o tratamento da fase aguda é o benzonidazol que, ao ser administrado por pacientes chagásicos por via oral, causa efeitos secundários indesejáveis (FIOCRUZ, 2019). A busca por novas substâncias mais eficazes e com menores efeitos colaterais para o paciente torna-se de grande importância. A ubiquinona (CoQ8) (MARECHALet al, p.1, 2010) é uma substância de origem natural que desempenha um papel fundamental imprescindível para a sobrevivência de microrganismos como T. cruzi, atuando na cadeia respiratória como aceptora de elétrons e, consequentemente, na geração de ATP. Sabendo-se deste fato, o planejamento de substâncias quinonoídicas 1a-d (Esquema 1) para o reconhecimento molecular do microrganismo, mas que, ao mesmo tempo, por estarem adequadamente funcionalizadas possam afetar negativamente na cadeia de transporte de elétrons do parasita, culminando com sua morte é uma estratégia interessante.
Material e métodos
Os métodos instrumentais de espectroscopia utilizados para a determinação estrutural das substâncias sintetizadas foram: Ressonância Magnética Nuclear de Hidrogênio (RMN de 1H), Carbono-13 (RMN de 13C) e Espectroscopia na região do Infravermelho (IV). As análises de RMN foram realizadas em espectrômetros Varian Unity (300 MHz/500 MHz) tendo como referência interna o TMS (Tetrametilsilano). Os valores de deslocamentos químicos (δ) foram referidos em partes por milhão (ppm) em relação ao TMS e as constantes de acoplamento (J) em unidades de Hertz (Hz). A obtenção das áreas dos sinais foi realizada por meio da integração eletrônica, sendo as multiplicidades descritas da seguinte forma: s- simpleto, d- dupleto, dd- duplo dupleto e m- multipleto.As análises de espectroscopia na região do IV foram realizadas em espectrofotômetro Perkin- Elmer FT-IR, modelos 1600 senes e espectrum One, de feixe duplo, em pastilhas de brometo de potássio anidro ou em feixe sobre janelas de cloreto de sódio em pastilhas de KBr anidro ou filme. Os valores para as absorções estão expressos em números de ondas, utilizando-se como unidade o centímetro recíproco (cm-1).Os pontos de fusão de todas as substâncias foram determinadas no aparelho de Fischer- Johns.O monitoramento das reações foi realizado através da técnica de cromatografia em camada delgada em cromatofolhas de gel de sílica 60F-254, com 0,2 mm de espessura de camada (ref. 1.05554 Merck).As purificações das substâncias foram realizadas por técnicas cromatográficas como: cromatografia em coluna utilizando as sílicas dos tipos sílica gel 60; 0,063-0,200mm (ref.1.055554 Merck) ou sílica gel do tipo flash 230-400 Mesh ASTM (0,035-0,070mm, ref. Acros Organics) e por placa preparativa sílica gel do tipo 60 P F254P (ref. 1077472500 Merk).
Resultado e discussão
O projeto teve início com a preparação da bromoquinona (3) via reação de
bromação da vanilina (2) com bromo molecular em meio de ácido acético. A
reação de oxidação de Dakin da vanilina bromada (3) com peróxido de
hidrogênio em meio básico levou à formação da bromobenzoquinona (4) com
rendimento de 55%, após sua purificação por técnica da recristalização com
n-hexano, conforme Esquema 1 (CALDWELLet al, p. 2092, 2009). A reação de
substituição nucleofílica (BOLOGNESI et al. p.2092, 2008) da quinona bromada
(4) com fenol (5a) e seus derivados 5b-d permitiu que os compostos alvo
correspondentes 1a-d fossem obtidos com rendimentos que variaram entre 29-
38%. O processo de purificação utilizado foi a cromatografia em coluna de
gel de sílica, para as substâncias 1a-b e cromatografia em placa preparativa
para os demais membros desta classe, utilizando como eluente uma mistura de
tolueno/ acetato de etila hexano/acetato de etila (9:1).
Os compostos alvo 1a-d tiveram suas estruturas elucidadas empregando-se as
técnicas espectroscópicas na Região do Infravermelho (IV) e de Ressonância
Magnética Nuclear de Hidrogênio (RMN de 1H) e Carbono (RMN de 13C).
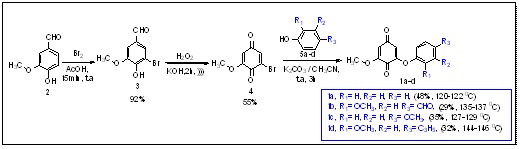
Preparação de derivados de arilóxi-benzoquinonas 1a-d.
Conclusões
A reação de substituição eletrofílica para bromação da vanilina (2) com bromo molecular mostrou-se eficiente, obtendo-se o composto bromado (3) com bom rendimento. A reação de oxidação da bromovanilina (3) com peróxido de hidrogênio em meio básico permitiu que o derivado de quinona (4) fosse obtido com bom rendimento. Por fim, através da reação de substituição nucleofílica da quinona bromada (4) com fenol 5a e seus derivados 5b-d em meio básico obteve- se as arilóxi-benzoquinonas correspondentes 1a-d com rendimentos que variaram entre 29-48%.
Agradecimentos
FAPERJ, CAPES, Universidade Federal Fluminense (UFF), Programa de Pós Graduação em Química da UFF (PPGQ-UFF), PIBITI/CNPq e Laboratório de Compostos Bioativos (LaCBio).
Referências
BERMUDEZ, J.; DAVIES, C.; SIMONAZZI, A.; REAL, P. J.; PALMA, S. Current drug therapy and pharmaceutical challenges for Chagas disease. Acta Tropica, 156,1-16, 2016.
BOLOGNESI, M. L.; LIZZI, F.; PEROZZO, R.; BRUN, R.; CAVALLI, A.; Synthesis of a small library of 2-phenoxy-1,4-naphthoquinone and 2-phenoxy-1,4-antraquinone derivatives bearing anti-trypanosomal and anti-leishmanial activity. Bioorganic &Medicinal Chemistry Letters18, 2272-2276, 2008.
DEYA, P. M.; DOPICO, M.; RASO, A. G.; MOREY, J.; SAA, J. M. On the Regioselectivity of the Fremy’s Salt Oxidations of Phenols. Tetrahedron, 43, 3523-3532, 1987.
RICH, R. P.; MARÉCHAL, A. The mitochondrial respiratory chain. Essays in Biochemistry, 47, 01-23, 2010.
SÍTIO DA FIOCRUZ <https://agencia.fiocruz.br/doençasnegligenciadas> acessado em 08 de Agosto de 2019.









