DESENVOLVIMENTO DE UMA NOVA METODOLOGIA PARA A SÍNTESE DE DERIVADOS DA CHALCONA
ISBN 978-85-85905-25-5
Área
Química Orgânica
Autores
Guimarães, R.B. (UEPB) ; Nóbrega, J.A. (UEPB)
Resumo
As chalconas possuem inúmeras propriedades biológicas, visto suas potenciais aplicações em diversas áreas da indústria. Essas moléculas têm exibido uma impressionante variedade de atividades biológicas, dentre as quais antimicrobiana, anti-inflamatória, antioxidante e antiviral. Visando sua importância, buscou-se um novo método para sua síntese de acordo com os princípios da química verde. As chalconas são sintetizadas por uma reação denominada Claisen-Schimdt envolvendo um aldeído e cetonas apropriados, por meio da maceração, utilizando bases para efetivar o processo de condensação e utilizando o PEG-400. A identificação dos produtos foi realizada por meio de espectroscopia RMN 1H e 13C. As reações se mostraram rápidas e os rendimentos obtidos foram bastante expressivos (acima de 90%).
Palavras chaves
Síntese orgânica; Chalconas; Condensação Aldólica
Introdução
Chalconas é um termo genérico dado para compostos químicos que apresentam a unidade estrutural 1,3-difenil-2-propen-1-ona e integrante da família dos flavonoides (MAAYAN; OHAD, 2005). Do ponto de vista químico, são flavonoides de cadeia aberta no qual dois anéis aromáticos estão unidos por um sistema carbonilado de 3 carbonos α, β-insaturados. As chalconas possuem inúmeras propriedades biológicas, por este motivo têm sido amplamente estudadas, visto suas potenciais aplicações em diversas áreas da indústria (SHAIK; VIDYA, 2015). No âmbito da indústria farmacêutica, são inúmeros os trabalhos que promovem o desenvolvimento de novos fármacos através da utilização dessas substâncias. Essas moléculas têm exibido uma impressionante variedade de atividades biológicas, dentre as quais antimicrobiana (GOPI; SASTRY; DHANARAJU, 2016; RITTER et al., 2014), anti-inflamatória (RÜCKER et al., 2015), antioxidante (ZAINURI et al., 2017) e antiviral (CHEN et al., 2015). Além disso, muitas chalconas têm exibido atividade citotóxica contra uma variedade de linhagens de células de câncer (DE VASCONCELOS et al., 2013; FOGAÇA et al., 2017; LIU et al., 2013; YADAV et al., 2016). O amplo espectro de atividades biológicas apresentados pelas chalconas por si só já qualificaria estas como promissoras para obtenção de princípios ativos, no entanto, outra característica tão importante quanto a mencionada anteriormente é a versatilidade sintética que estes compostos possuem, acarretando uma versatilidade ainda maior quando os mesmos são comparados com outros produtos naturais, aumentando consideravelmente o interesse químico e farmacológico nestas moléculas. Neste sentido, vem despertando na comunidade científica a busca pelo desenvolvimento de novos métodos para a obtenção das chalconas.
Material e métodos
A síntese das chalconas ocorreu através de uma mistura equimolar dos reagentes. Em um almofariz colocou-se a acetofenona (1 mmol), o benzil (1 mmol), o catalizador básico, nesse caso o NaOH (1 mmol) e por fim, 1 mL de PEG-400. A mistura foi macerada, sendo os reagentes atritados por um período de 10 minutos. A formação do produto foi acompanhada por cromatografia de camada delgada (CCD) utilizando placas de vidro revestidas de sílica gel 60 GF 254 (Merck), o eluente utilizado foi hexano/acetato de etila com polaridade 90:10, a revelação dos produtos foi realizada através do vapor de iodo. Posteriormente, a mistura foi neutralizada com 10 mL de solução de ácido clorídrico (0,5 M). Na sequência, foi realizada uma partição (L/L), utilizando salmoura e acetato de etila. Logo após a extração da fase orgânica, foi adicionado sulfato de magnésio como agente secante, e então filtrado. A fase orgânica foi concentrada à vácuo, através do evaporador rotativo (Quimis) e posteriormente submetido a coluna cromatográfica (CC), método utilizado para purificação do produto, que consistiu em uma bureta preenchida com sílica gel (Merck, 70 – 230 mesh ASTM), como adsorvente. Como eluentes, os solventes orgânicos hexano/acetato de etila, aumentando-se a polaridade gradativamente (90:10; 80:20, 70:30, 50:50 e 0:100). As demais reações foram conduzidas de modo semelhante. Utilizou-se recipientes de vidro, para recolher pequenas frações do eluente, onde a verificação dessas frações foi realizada através da CCD. A determinação do ponto de fusão das amostras foi determinada através do medidor de ponto de fusão Hydrosan PFM-II. Os espectros de Ressonância Magnética Nuclear (RMN) 1H (200 MHz) e 13C (50 MHz) foram obtidos no espectrômetro Varian Mercury 200 ((LTF) – UFPB).
Resultado e discussão
A reação envolveu a combinação de acetofenonas selecionadas com o benzil em quantidades estequiométricas e na presença de base. O suporte de reação escolhido foi o PEG-400 pois ele apresenta propriedades de solvatação e ativação nucleofílica que o tornam mais eficiente que os solventes polares próticos comumente utilizados nas reações de condensação de Claisen-Schmidt, como o metanol ou o etanol. Por sua vez, a base utilizada, NaOH, também apresentou bom desempenho assim como nas reações de condensação de Claisen-Schmidt, a qual foi eficiente na reação, promovendo a desprotonação da acetofenona, o que levou a formação do íon enolato e consequente formação do produto da reação. Os exemplos estudados, reações com acetofenona, 3-metóxiacetofenona e 4-metilacetofenona, apresentaram comportamento similar.
As reações se mostraram rápidas, com mudança de coloração à medida que os reagentes eram atritados, com poucos minutos de maceração, e os rendimentos obtidos foram bastante expressivos (acima de 90%). A reação pode ser compreendida, simplesmente, como a adição nucleofílica de um íon enolato gerado a partir da acetofenona em uma das carbonilas da 1,2-diona. A análise e caracterização do produto das condensações aldólicas foi feita, basicamente, por Ressonância Magnética Nuclear (RMN 1H e 13C). Os dados espectrométricos que suportam essas identificações estão apresentados no quadro 2 e exemplificados para a chalcona 1. Um dos aspectos mais interessantes destes dados se referem as diferenças de deslocamento químico observado para os agrupamentos carbonila. O grupo C=O geminal ao grupo fenil na insaturação (C8) mostra uma significativa desproteção, resultado do efeito eletrônico associado ao anel aromático.
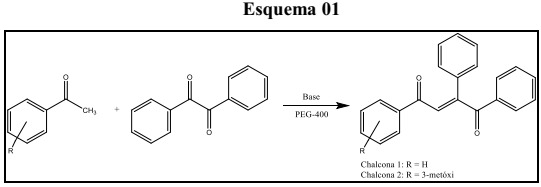
Obtenção do derivado de chalcona a partir do benzil.
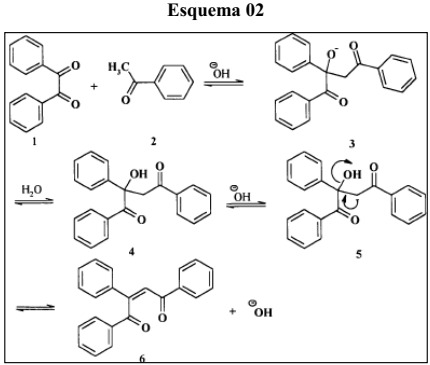
Mecanismo de reação das chalconas
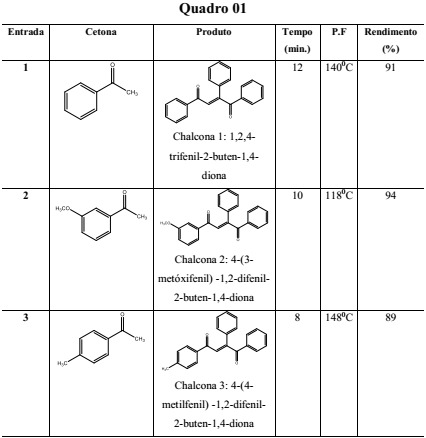
Dados reacionais dos produtos obtidos
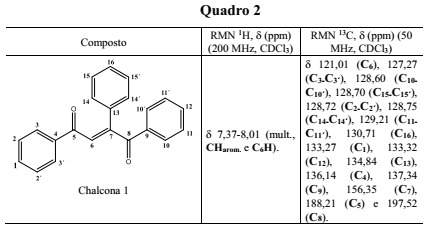
Dados de RMN 1H e 13C importantes para a chalcona 1
Conclusões
A metodologia utilizada, mostrou ser inovadora e eficiente na obtenção do esqueleto chalcônico. O uso do benzil aliado a maceração, possibilitou desenvolver a síntese de forma fácil e reprodutiva, fornecendo uma elevada eficiência para as reações selecionadas, e substituindo a necessidade de utilizar reagentes tóxicos, grandes quantidades de solventes e uso da energia elétrica, o que permitiu propor uma metodologia de acordo com os princípios da química verde. O melhor resultado alcançado foi a combinação da 3-metóxiacetofenona com o benzil, obtendo-se um excelente rendimento (94%).
Agradecimentos
Ao orientador deste projeto Professor José Arimatéia Nóbrega; A Universidade Estadual da Paraíba - UEPB/PIBIC pelo apoio financeiro ao projeto e a autora Guimarães, R.B.
Referências
CHEN, Z. et al. Synthesis, antiviral activity, and 3D-QSAR study of novel chalcone derivatives containing malonate and pyridine moieties. Arabian Journal of Chemistry, 2015.
DE VASCONCELOS, A. et al. Cytotoxic and apoptotic effects of chalcone derivatives of 2-acetyl thiophene on human colon adenocarcinoma cells. Cell Biochemistry and Function, v. 31, n. 4, p. 289–297, 2013.
FOGAÇA, T. B. et al. Apoptotic effect of chalcone derivatives of 2-acetylthiophene in human breast cancer cells. Pharmacological Reports, v. 69, p. 156 -161, 2017.
GOPI, C.; SASTRY, V. G.; DHANARAJU, M. D. Synthesis and spectroscopic characterisation of novel bioactive molecule of 3-(2-substituted)-1H-indol-3-yl)-1-(thiophen-2yl)-prop-2-en-1-one chalcone derivatives as effective antioxidant and antimicrobial agents. Beni-Suef University Journal of Basic and Applied Sciences, 2016.
LIU JJ, ZHAO MY, ZHANG X, ZHAO X, Z. H. Pyrazole derivatives as antitumor, anti-inflammatory and antibacterial agents. Mini Reviews in Medicinal Chemistry, v. 13, n. 13, p. 1957–1966, 2013.
MAAYAN S, OHAD N, SOLIMAN K. Chalcones as potent tyrosinase inhibitors: the importance of a 2,4-substituted resorcinol moiety. Bioorg Med Chem 13(2): 433-441, 2005.
RITTER, M. et al. Recent Advances on the Synthesis of Chalcones with Antimicrobial Activities: A Brief Review. Letters in Organic Chemistry, v.13, p. 498–508, 2014.
RÜCKER, H. et al. Enhancing the anti-inflammatory activity of chalcones by tuning the Michael acceptor site. Organic & biomolecular chemistry, v. 13, n. 10, p. 3040–7, 2015.
SHAIK, K. Y., AFZAL, B S. Chemical and Biological Potentials of Chalcones: A Review. Organic & Medicinal Chem IJ. 1(1), 2015.
YADAV, P. et al. Green synthesis and anticancer potential of chalcone linked-1,2,3 triazoles. European Journal of Medicinal Chemistry, 2016.
ZAINURI, D. A. et al. Synthesis, XRD crystal structure, spectroscopic characterization (FT-IR, 1H and 13C NMR), DFT studies, chemical reactivity and bond dissociation energy studies using molecular dynamics simulations and evaluation of antimicrobial. Journal of Molecular Structure, v. 1128, p. 520–533, 2017.









