Síntese, caracterização e estudo conformacional da 4-hidroxichalcona
ISBN 978-85-85905-25-5
Área
Química Orgânica
Autores
Kerek, A.L. (LESCAM/PPGQA/UEPG) ; Rozada, T.C. (DEQUIM/UEPG) ; Fiorin, B.C. (LESCAM/DEQUIM/UEPG)
Resumo
O objetivo do trabalho foi a síntese, caracterização e o estudo conformacional da 4-hidroxichalcona. A referida chalcona foi obtida através de uma reação de Claisen-Schmidt. O produto foi devidamente caracterizado pelas espectroscopias de IV e RMN, sendo que esta última técnica foi de extrema importância para verificar a presença da dupla ligação vinílica formada na reação e para determinar a configuração trans da mesma. Paralelo as atividades experimentais, foram realizados cálculos teóricos para a determinação do equilíbrio conformacional. A estrutura s-cis (89%), apresentou uma menor energia em relação ao outro confôrmero obtido, ou seja, um maior efeito estabilizante, o qual foi observado pelos cálculos de NBO (505,34 kcal mol-1), resultante da sua planaridade.
Palavras chaves
Chalcona; RMN; Cálculo teórico
Introdução
As chalconas, com estrutura geral 1,3-difenil-2-propen-1-ona (PATIL et al. 2009), são cetonas α,β-insaturadas, que estão presentes nas principais estruturas dos vegetais, como raízes, folhas e flores e são precursores naturais dos flavonoides. Sinteticamente, é possível a obtenção de chalconas com diversos substituintes visando adquirir compostos com propriedades de interesse farmacológico, como por exemplo, as atividades antimicrobiana, antifúngica, antimalárica, antiviral, anti-inflamatória e anticâncer (GAONKAR; VIGNESH, 2017). Existem diferentes métodos para a obtenção de chalconas através de rotas sintéticas, sendo a mais comum a condensação de Claisen-Schmidt, com catálise homogênea ácida ou básica. Após a síntese, os produtos são caracterizados e analisados para a verificação da pureza do composto, bem como suas características e possíveis aplicabilidades (SINGH et al. 2014). As caracterizações mais comuns são as Espectroscopias no Infravermelho com Transformada de Fourier (IV) e a Ressonância Magnética Nuclear de 1H e 13C (RMN). As análises de atividade antioxidante, antibacteriana, antifúngica e anticâncer são as aplicações mais visadas (ROZMER; PERJÉSI, 2016). São realizados também cálculos teóricos das chalconas, como estudos utilizando a teoria do funcional da densidade (DFT), que fornece bons resultados para explicar propriedades eletrônicas e estruturais, as quais podem-se destacar o estudo conformacional, momento de dipolo, vibrações moleculares, entre outras. Esses dados podem ser correlacionados com os resultados obtidos experimentalmente (ARSHAD et al. 2017; JAGADEESH et al. 2015). Com isso, o intuito deste trabalho foi a síntese, caracterização e estudo conformacional da 4-hidroxichalcona.
Material e métodos
Primeiramente foi realizada a síntese da 4-hidroxichalcona pelo método de Claisen-Schmidt, com catálise homogênea básica, utilizando uma solução 40% de hidróxido de sódio. Adicionou-se a um balão de fundo redondo, o 4- hidroxibenzaldeído (0,01 mol), a acetofenona (0,01 mol), 10 mL de metanol e o catalisador. A mistura reacional foi mantida sob agitação a temperatura ambiente, por um período de 24 h, conforme a metodologia descrita por Yazdan et al. (2014). Realizou-se a caracterização por RMN de 1H, no espectrômetro de ressonância magnética nuclear- Bruker 400MHz, AVANCE III, utilizando-se aproximadamente 20 mg do composto em CDCl3, com tetrametilsilano (TMS) como referência interna e temperatura da probe mantida próxima de 25 °C. Já a análise de IV, foi realizada no espectrômetro Shimadzu FT-IR Prestige-21, com as amostras sendo preparadas em pastilha de brometo de potássio (KBr) e as condições de operação do equipamento foram de 64 scans, resolução de 4 cm-1 e a faixa analisada foi de 400-4000 cm-1. Além disso, realizou-se cálculos teóricos para obtenção do equilíbrio conformacional, para isso utilizou-se um computador com ambiente de trabalho Linux. Os cálculos de scan, otimização e frequência foram adquiridos utilizando o pacote de programas Gaussian 09 (FRISCH et al. 2010) e os cálculos de orbitais naturais de ligação (NBO) foram realizados com o programa NBO 5.9 (GLENDENING, et al. 2009), com o nível de teoria M06-2X/6- 311G++(2d,2p), para os cálculos de otimização e frequência.
Resultado e discussão
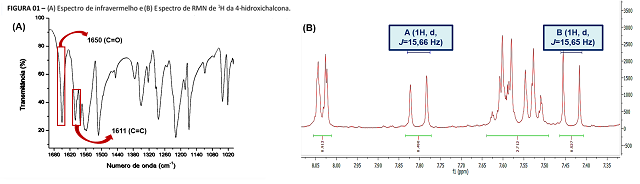
Foram realizadas as caracterizações de IV e RMN de 1H. Pelo IV
observou-se a presença de bandas em 1650 e 1611 cm-1,
relacionadas as ligações C=O e C=C, respectivamente (Figura 01.A). Através
do espectro de RMN, foi possível analisar a estereoquímica da 4-
hidroxichalcona no que diz respeito a ligação dupla vinílica. Verificou-se
um sinal, na forma de um dupleto, com δ=7,80 ppm proveniente do hidrogênio
vinílico α-carbonílico e com constante de acoplamento JHαHβ de
15,66 Hz. Observou-se outro sinal, também como um dupleto, com δ=7,44 ppm,
que corresponde ao hidrogênio vinílico β-carbonílico e com a constante de
acoplamento JHβHα de 15,65 Hz, conforme mostrado na Figura 01.B.
Esses valores vão de acordo com os descritos na literatura para chalconas,
caracterizando um valor comum para acoplamento trans próton-próton pela
ligação dupla (HASAN et al. 2005; PAVIA et al. 2010). O rendimento final da
síntese foi de 35,18%.
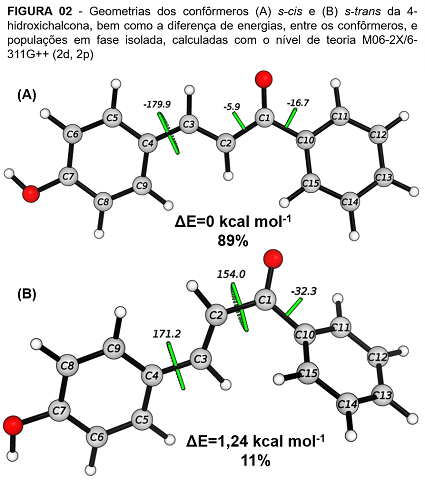
Com relação ao estudo conformacional, foram encontradas duas estruturas de
mínimo de energia para a chalcona em estudo (Figura 02). A estrutura com
configuração s-cis (A), foi a mais estável, com uma população de 89%
no equilíbrio, enquanto a estrutura s-trans (B) apresentou uma
variação de energia de 1,24 kcal mol-1, em relação ao outro confôrmero,
representando uma população de 11%. A maior estabilidade da conformação
s-cis pode ser explicada pela maior planaridade da molécula. Essa
característica proporciona uma maior interação orbital do tipo π→π* conforme
pode ser avaliado pelas análises de NBO, onde a conformação s-cis
apresentou maior efeito estabilizante do que a conformação s-trans
(505,34 e 494,91 kcal mol-1, respectivamente) ao considerar esse tipo de
interação orbital.
FONTE: Os Autores.
FONTE: Os Autores.
Conclusões
Com o procedimento adotado foi possível a obtenção da 4-hidroxichalcona, sendo sua estrutura confirmada pelas análises espectroscópicas. Foi possível verificar com os cálculos teóricos as geometrias envolvidas no equilíbrio conformacional, sendo a estrutura s-cis a de menor energia. A maior estabilidade na estrutura s-cis, encontrada pelo cálculo de NBO, se deve a sua maior planaridade em relação ao confôrmero s-trans.
Agradecimentos
Agradeço primeiramente ao LEsCaM pelo apoio e ajuda na realização do trabalho, ao CNPq, a CAPES e a Fundação Araucária pelo fomento à pesquisa, e a UEPG por toda a estrutura disponibilizada.
Referências
ARSHAD, M. N.; AL-DIES, A.-A. M.; ASIRI, A. M.; et al. Synthesis, crystal structures, spectroscopic and nonlinear optical properties of chalcone derivatives: A combined experimental and theoretical study. Journal of Molecular Structure, v. 1141, p. 142–156, 2017. Elsevier B.V.
FRISCH, M. J.; TRUCKS, G. W.; SCHLEGEL, H. B.; SCUSERIA, G. E.; ROBB, M. A.; CHEESEMAN, J. R.; SCALMANI, G.; BARONE, V.; MENNUCCI, B.; PETERSSON, G. A.; NAKATSUJI, H.; CARICATO, M.; LI, X.; HRATCHIAN, H. P.; IZMAYLOV, A. F.; BLOINO, J.; ZHENG, G.; SONNENBERG, J. L.; HADA, M.; EHARA, M.; TOYOTA, K.; FUKUDA, R.; HASEGAWA, J.; ISHIDA, M.; NAKAJIMA, T.; HONDA, Y.; KITAO, O.; NAKAI, H.; VREVEN, T.; MONTGOMERY, JR., J. A.; PERALTA, J. E.; OGLIARO, F.; BEARPARK, M.; HEYD, J. J.; BROTHERS, E.; KUDIN, K. N.; STAROVEROV, V. N.; KEITH, T.; KOBAYASHI, R.; NORMAND, J.; RAGHAVACHARI, K.; RENDELL, A.; BURANT, J. C.; IYENGAR, S. S.; TOMASI, J.; COSSI, M.; REGA, N.; MILLAM, J. M.; KLENE, M.; KNOX, J. E.; CROSS, J. B.; BAKKEN, V.; ADAMO, C.; JARAMILLO, J.; GOMPERTS, R.; STRATMANN, R. E.; YAZYEV, O.; AUSTIN, A. J.; CAMMI, R.; POMELLI, C.; OCHTERSKI, J. W.; MARTIN, R. L.; MOROKUMA, K.; ZAKRZEWSKI, V. G.; VOTH, G. A.; SALVADOR, P.; DANNENBERG, J. J.; DAPPRICH, S.; DANIELS, A. D.; FARKAS, O.; FORESMAN, J. B.; ORTIZ, J. V.; CIOSLOWSKI, J.; FOX, D. J. Gaussian 09, Revision B.01, Gaussian, Inc., Wallingford CT, 2010.
GAONKAR, S. L.; VIGNESH, U. N. Synthesis and pharmacological properties of chalcones: a review. Research on Chemical Intermediates, v. 43, n. 11, p. 6043–6077, 2017.
GLENDENING, E. D.; BADENHOOP, J. K.; REED, A. E.; CARPENTER, J. E.; BOHMANN, J. A.; MORALES, C. M.; WEINHOLD, F. NBO 5.9. (Theoretical Chemistry Institute, University of Wisconsin, Madison, WI, 2009); http://www.chem.wisc.edu/~nbo5.
HASAN, A.; KHAN, K. M.; SHER, M.; et al. Synthesis and inhibitory potential towards acetylcholinesterase, butyrylcholinesterase and lipoxygenase of some variably substituted chalcones. Journal of Enzyme Inhibition and Medicinal Chemistry, v. 20, n. 1, p. 41–47, 2005.
JAGADEESH, M.; LAVANYA, M.; HARI BABU, B.; et al. Synthesis and detailed spectroscopic characterization of various hydroxy-functionalized fluorescent chalcones: A combined experimental and theoretical study. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, v. 150, p. 557–564, 2015. Elsevier B.V.
PATIL, C. B.; MAHAJAN, S. K.; KATTI, S. A. Chalcone: A versatile molecule. Journal of Pharmaceutical Sciences and Research, v. 1, n. 3, p. 11–22, 2009.
PAVIA, D. L.; LAMPMAN, G. M.; KRIZ, G. S.; VYVYAN, J. R. Introdução à Espectroscopia. 4a Edição ed. São Paulo: CENGAGE Learning, 2010.
ROZMER, Z.; PERJÉSI, P. Naturally occurring chalcones and their biological activities. Phytochemistry Reviews, v. 15, n. 1, p. 87–120, 2016.
SINGH, P.; ANAND, A.; KUMAR, V. Recent developments in biological activities of chalcones: A mini review. European Journal of Medicinal Chemistry, v. 85, p. 758–777, 2014. Elsevier Masson SAS.
YAZDAN, S. K.; KUMAR, K. S.; RATNABHUSHANAM, B.; et al. Synthesis of Acetophenone Chalcone Derivatives And their Antibacterial Activity. Journal of Applicable Chemistry, v. 3, n. 2, p. 601–605, 2014.









