Semissíntese de derivados do diterpeno pimarano Annonalida
ISBN 978-85-85905-21-7
Área
Produtos Naturais
Autores
Santos, A.L.P. (UNIVERSIDADE FEDERAL DO CEARÁ) ; Vieira, T.D.N. (UNIVERSIDADE FEDERAL DO CEARÁ) ; Vasconcelos, A.O. (UNIVERSIDADE FEDERAL DO CEARÁ) ; Brito, M.V. (UNIVERSIDADE FEDERAL DO CEARÁ) ; Mattos, M.C. (UNIVERSIDADE FEDERAL DO CEARÁ) ; Marques, R. (UNIVERSIDADE FEDERAL DO CEARÁ) ; Oliveira, M.C.F. (UNIVERSIDADE FEDERAL DO CEARÁ)
Resumo
A annonalida é um diterpeno do tipo pimarano isolado de Casimirella ampla (anteriormente Humirianthera ampla), e que apresenta atividade citotóxica. Neste trabalho relata-se a semissíntese de oito derivados deste produto natural, sendo sete deles inéditos na literatura. As reações foram realizadas na cadeira lateral do diterpeno, visando aumentar sua lipofilicidade e introduzir halogênios na molécula. As estruturas de todos os compostos foram estabelecidas com base em seus dados de RMN 1D e 2D e espectrometria de massas.
Palavras chaves
annonalida; semissíntese; diterpeno pimarano
Introdução
Os produtos naturais e seus derivados semisintéticos têm sido amplamente investigados como fontes de novos candidatos de drogas com uma variedade de atividades farmacológicas [1, 2]. Essas duas classes de compostos representaram 25% de todas as novas drogas aprovadas durante os anos 1981- 2014 [1], sendo que destes, os derivados de produtos naturais representam a maior parte (21%). Desta forma, a semisíntese é uma ferramenta importante para melhorar a atividade biológica de produtos naturais, para não mencionar melhorias em outros parâmetros importantes como toxicidade, seletividade, lipofilicidade e biodisponibilidade. Aumentar a lipofilicidade e introduzir átomos de halogêneo nos produtos naturais são exemplos de modificações que melhoraram a atividade biológica [2]. A annonalida (1) é um diterpeno do tipo pimarano que foi inicialmente isolado de Annona coriacea (Annonaceae) [3-5] e posteriormente de Casimirella ampla (anteriormente Humirianthera ampla) [6-8]. Este produto natural foi previamente avaliado quanto ao seu potencial antitumoral contra a linhagem de celula de câncer de ovário humano A2780 e apresentou IC50 de 3,9 μM. Também foi submetida ao ensaio frente 60 linhagens de células tumorais do National Cancer Institute (NCI) e apresentou IC50s variando de 4.8 a >100 μM [7]. Nesse trabalho, relatamos a semisíntese de oito derivados da annonalida (2- 9), dentre os quais os compostos 3-9 são inéditos. As estruturas de todos os compostos foram estabelecidas com base em seus dados de RMN 1D e 2D e espectrometria de massas.
Material e métodos
A annonalida (1) foi isolada a partir das raízes (9,0 Kg) de Casimirella ampla. Sucessivos fracionamentos cromatográficos do extrato AcOEt da planta forneceu 3,2 g do produto natural puro. A uma solução de 1 (30,4 mg, 0,084 mmol) em CH2Cl2 (5 mL), sob agitação magnética, foram adicionados 19,6 mg (0,16 mmol) de DMAP. Após 10 min, adicionou-se 150 μL de anidrido acético ao sistema. A mistura reacional foi agitada à temperatura ambiente por 3 h. O produto bruto foi purificado por cromatografia tipo flash sobre gel de sílica (CHCl3-isopropanol, 97,5:2,5) fornecendo 29,3 mg (96%) de 2 puro. A uma solução de 1 (0,06 mmol) em CH2Cl2 (5 mL), sob agitação magnética, adicionou-se DMAP (33,7 mg, 0,28 mmol). Após 10 minutos, adicionou-se 5,0 equivalentes do cloreto de acila correspondente (cloreto de propionila, cloreto de hexanoíla ou cloreto de decanoíla). A mistura foi agitada à temperatura ambiente durante 3 h. Os derivados foram purificados por cromatografia flash sobre gel de sílica (CHCl3-isopropanol, 97,5: 2,5). A uma solução de 1 (108,6 mg, 0,3 mmol) em CH2Cl2 (10 mL), sob agitação magnética, foram adicionados 418,7 μL (3 mmol) de trimetilamina e a mistura foi resfriada a 0 ºC num banho de gelo. Em seguida, adicionou-se cloreto de mesila (92,88 μL, 1,2 mmol) à mistura reacional. Após 2 h, a reacção foi encerrada pela adição de água destilada (10 mL), seguido de extração com CH2Cl2 (3 x 10 mL). A fase orgânica foi seca sobre Na2SO4 anidro e filtrada. O solvente foi removido sob pressão reduzida e o resíduo foi purificado por cromatografia em coluna de fase normal (22 x 1 cm) eluída com CHCl3/isopropanol (95:5) para proporcionar 70 mg (53%) do produto mesilado puro (6). A uma solução de 6 (0,056 mmol) em acetona (15 mL), sob agitação magnética, adicionou-se 20 eq. molares d
Resultado e discussão
A annonalida (1) foi isolada a partir dos tubérculos secos de C. ampla com
um rendimento de 0,036%. A elucidação da estrutura deste produto natural
baseou-se, principalmente, na análise dos seus dados de RMN 1H e 13C e EMAR.
A ausência de dados de RMN 13C para 1 na literatura, nos levou a atribuir
seu espectro de RMN 13C com a ajuda dos dados de RMN 2D (HSQC e HMBC).
A estrutura da annonalida (1) exibe uma variedade de grupos funcionais
incluindo hidroxila e carbonila na cadeia lateral em C-13, além de um anel
lactona e uma porção hemicetal. Inicialmente, a derivação de 1 implicou
acilação do grupo hidroxila primário da cadeia lateral para fornecer 2-5
(Esquema 1), uma vez que de que o aumento da lipofilicidade da molécula pode
melhorar a sua atividade biológica frente à células tumorais. Os derivados
foram produzidos em excelentes rendimentos e todos os dados espectrométricos
estão compatíveis com as estruturas dos mesmos.
Sabe-se que a incorporação de um átomo de halogênio em alguns produtos
naturais melhora sua atividade citotóxica [9]. Assim, realizou-se a
semissíntese dos novos análogos halogenados 7-8 que contém Cl, Br e I,
respectivamente. A preparação destes derivados foi realizada a partir do
composto mesilado 6 (Esquema 2), e os compostos halogenados foram produzidos
em rendimentos variados. Todos os dados espectrométricos dos derivados estão
compatíveis com as estruturas dos mesmos.
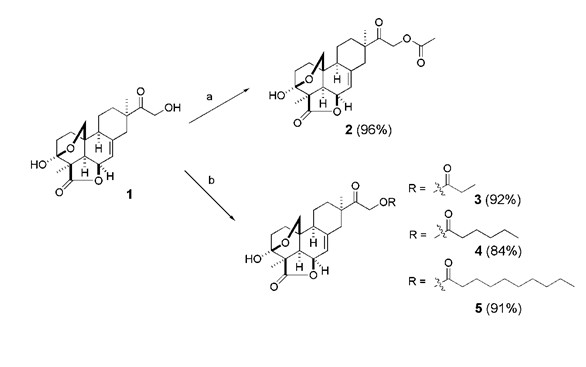
Preparação dos derivados 2-5: (a) anidrido acético, piridina, CH2Cl2; (b) RCOCl, DMAP, CH2Cl2.

Semissíntese dos derivados 6-9: (a) MsCl, Et3N, CH2Cl2, 0°C; (b) NaX, acetona.
Conclusões
Em suma, novos derivados do diterpeno cititóxico annonalida foram preparados por semissíntese em rendimentos que variaram de bom a excelentes. Todas as modificações estruturais ocorreram na cadeia lateral do produto natural, tanto pela introdução de grupos acilas como de halogênios. Todos os compostos serão submetidos à atividade citotóxica para avaliar a relação estrutura-atividade dos mesmos.
Agradecimentos
Fundação Cearense de Apoio a Pesquisa (FUNCAP), Conselho Nacional do Desenvolvimento Científico e Tecnológico (CNPq), Coordenação de Aperfeiçoamento de Pessoal de Nív
Referências
[1] D. J. Newman, G. M. Cragg. Natural products as sources of new drugs from 1981 to 2014, Journal of Natural Products, 79 (2016) 629-61.
[2] E. C. Barnes, R. Kumar, R. A. Davis. The use of isolated natural products as scaffolds for the generation of chemically diverse screening libraries for drug discovery, Natural Product Reports, 33 (2016) 372-81.
[3] P. Mussini, F. Orsini, F. Pelizzoni, G. Ferrari. Constituents of Annona coriaceae. The strucuture of a new diterpenoid, J. Chem. Soc., Perkin Trans. I, 21 (1973) 2551-7.
[4] P.Mussini, F. Orsini, F. Pelizzoni. The C-13 configuration of annonalide, Tetraedron Letters, (1973) 4849-51.
[5] F. Orsini, F. Pelizzoni. The structure of annonalide, Tetrahedron Letters, 12 (1977) 1085-8.
[6] I. B. Graebner, M. A. Mostardeiro, E. M. Ethur, R. A. Burrow, E. C. S. Dessoy, A. F. Morel. Diterpenoids from Humirianthera ampla, Phytochemistry, (2000) 955-9.
[7] I. B. Graebner, A. F. Morel, R. A. Burrow, M. A. Mostardeiro, E. M. Ethur, E. C. M. Dessoy, A. Scher. Diterpenos isolados de Humirianthera ampla. Miers. Revista Brasileira de Farmacognosia, 12 (2002) 80-1.
[8] E. Adou, R. B. Williams, J. K. Schilling, S. Malone, J. Meyer, J. H. Wisse, D. Frederik, D. Koese, M. C. M. Werkhoven, C. E. Snipes, T. L. Werk, D. G. Kingston. Cytotoxic diterpenoids from two lianas from the Suriname rainforest, Bioorganic and Medicinal Chemistry, 13 (2005) 6009-14.
[9] U. Abel, W. Simon, P. Eckard, F. G. Hansske. Design and semisynthesis of novel fredericamycin A derivatives with an improved antitumor profile, Bioorganic & Medicinal Chemistry Letters, 16 (2006) 3292–7.
































