ANÁLISE QUÍMICA PRELIMINAR DE EXTRATOS DE MÉDIA E ALTA POLARIDADE DO MACROFUNGO ENTOMOPATOGÊNICO Ophiocordyceps australis (Ascomycota).
ISBN 978-85-85905-21-7
Área
Produtos Naturais
Autores
Almeida de Menezes, T. (UEFS) ; Santos Pereira, R. (UESB) ; Santos Pereira, R. (UESB) ; Menezes de Oliveira, D. (UESB) ; Drechsler-santos, E.R. (UFSC) ; Silva Andrade, B. (UESB) ; Góes-neto, A. (UFMG)
Resumo
Ophiocordyceps australis é um macrofungo entomopatogênico que tem sido pouco estudado visando uma prospecção química. Assim, o presente trabalho teve como objetivo produzir extratos brutos dessa espécie em solventes orgânicos (acetato de etila e metanol) para investigação química, utilizando testes para detecção de taninos (FeCl3), triterpenos pentacíclicos, TTPC (Liberman- Burchard), e flavonoides (Shinoda); bem como a aplicação de CCD e análise de espectros na região do infravermelho. Para obtenção desses extratos, o fungo foi cultivado em diferentes fermentações e meios. Os resultados desses testes e análise por infravermelho podem indicar a presença de metabólitos pertencentes à classe dos TTPC. As das bandas nos espectros na região do IV foram atribuídas a compostos triterpênicos.
Palavras chaves
Ophiocordyceps; Fermentação; TTPCs
Introdução
Os macrofungos entomopatógenos são caracterizados por parasitar diversas ordens de insetos, bem como alguns membros da Classe Arachnida e utilizar o corpo desses animais como substrato para completar parte do seu ciclo de vida, produzindo suas estruturas reprodutivas. A maioria desses macrofungos faz parte da ordem Hypocreales (Ascomycota), sendo conhecidos como Cordyceps s.l., tendo como principal família Ophiocordycipitaceae (FREIRE, 2015). Esses macrofungos tem apresentado destaque no meio científico por causa de sua importância ecológica, além de seu potencial econômico na produção de biocompostos e uso como biocontrole (SASAKI et al., 2012; XIANG et al., 2013). O. australis é um macrofungo entomopatógeno que parasita formigas (Hymenoptera), principalmente operárias, e possui ampla distribuição geográfica, que parece seguir a distribuição do hospedeiro. Assim, podem ser encontrados sob ou sobre serapilheira, em ambientes úmidos e bastante arborizados. Morfologicamente, a espécie é caracterizada por apresentar estipe longo, filiforme, com coloração escura (marrom a preto), resistente (pouco flexível) e região fértil terminal com cor intensa (vermelho ou vermelho alaranjado), com forma elipsoide a subglobosa (FREIRE, 2012). O objetivo deste estudo foi obter extratos brutos do macrofungo Ophiocordyceps australis em diferentes meios de cultura e condições de cultivo e determinar o perfil químico dos extratos.
Material e métodos
O macrofungo entomopatogênico Ophiocordyceps australis (CCMB661), foi coletado em Florianópolis, SC no período de 06 a 13 de janeiro de 2016. Após isolamento e obtenção da cultura pura, foi feita a extração do DNA genômico do micélio de acordo com Doyle & Doyle (1987). A linhagem fúngica (CCMB661) foi cultivada em 4 meios de cultura distintos (Batata dextrose, Sabouraud dextrose, Extrato de malte e Extrato de levedura sacarose) por fermentações sólida, líquida estática e submersa, sendo incubada em estufa tipo B.O.D, no escuro, a temperatura de ± 27°C, por 30 dias. Para obtenção dos extratos brutos fúngicos (CCMB661), primeiramente a biomassa e secretoma resultantes dos cultivos em estudo foram liofilizados. Posteriormente, empregou-se a técnica de extração exaustiva por maceração a 25°C durante 15 dias, utilizando como solventes extratores acetato de etila e metanol. Alíquotas dos extratos brutos em acetato de etila foram submetidos ao teste de Lieberman-Burchard (L-B), o qual evidencia a presença de triterpenos (MATOS, 2009). A prospecção química por flavonoides nos extratos em acetato de etila foi feita através da reação de Shinoda. E também foi realizado o teste para detecção de fenólicos da classe dos taninos. O perfil cromatográfico dos extratos foi analisado por cromatografia em camada delgada (CCD). Utilizado como revelador à vanilina (1%) e ácido perclórico (3%) misturados na proporção 1:1. Os extratos brutos metanólicos foram submetidos a um processo de purificação por lavagem e recristalização. Onde foram obtidos três amostras dos sólidos S1, S2 e S3 que foram analisadas no infravermelho, marca Perkin Elmer, modelo Spectrum-TWO, FT-IR/ATR.
Resultado e discussão
O perfil por CCD indicou presença de compostos terpênicos nos extratos em
acetato, devido as manchas roxas e marrom claro. Os resultados de L-B também
confirmaram esse perfil (Tabela 1), devido as colorações róseas-arroxeadas
(núcleo triterpênico) e castanhas (éster triterpênico). Através do teste de
Shinoda confirmou-se ausência de flavonoides. O teste para identificar
polifenóis também foi negativo.
Os sólidos dos extratos em MeOH, S1 e S2 em L-B apresentaram coloração
castanha e S3 rósea.
Os espectros no infravermelho mostraram que S1 e S2 são semelhantes quanto
às absorções (Tabela 2). Os espectros de S1/S2 mostraram bandas de composto
derivado de aminoácido dotado de um ou mais anéis aromáticos, possivelmente
se trata de derivado de lisina ou fenilamina. O espectro no IV de S1/S2
mostrou banda larga e intensa em 3366 cm-1 característica de O-H e N-H de
álcoois, fenóis e/ou aminas. Observou-se bandas de absorção associadas a
ν(=C-H) em 3036 e 3000 cm-1 de alquenos ou aromáticos. As bandas em 1604 e
1578 cm-1 foram atribuídas a ν(C=O) de carbonila quelada e em 1513 e 1455
cm-1 a ν(C=C), ambas em aminoácidos α,β-insaturados. Absorções entre 2960-
2840 foram atribuídas a parte alquila (CH2 e CH3) do composto constituinte
dos sólidos (S1/S2). Teste Liebermann-Burchard com S3 foi positivo para
TTPC’s e seu espectro no infravermelho indicaram que se tratava de um éster
alcanoiloxi de esteroide ou TTPC. O espectro no IV mostrou bandas em 2922 e
2852 cm-1 características de deformações axiais de C-H de CH2 e CH3,
respectivamente. A ausência de banda de forte intensidade, relacionada a
ν(O-H), na região 3200-3700 cm-1 e ocorrência de banda em 1745 cm-1
acompanhada de outras duas de baixas intensidades em 1276 e 1255 cm-1 ν(C-O-
C), evidenciaram que S3 se tratava de um éster.

BDA: batata dextrose agar; YES: ex. levedura sacarose; MEA: ex. malte ágar; SDA: sabouraud dextrose ágar; EM: extrato de malte; SD: sabouraud dextrose
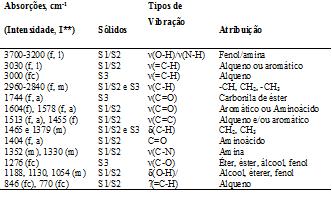
Legenda: ν: estiramento; δ: dobramento ou deformação angular γ: torção; **(I, Intensidade: f = forte, fc = fraca, m = média, l = larga, a = aguda
Conclusões
Os extratos em acetato de etila de O. australis sugerem a ocorrência de compostos TTPCs, devido aos resultados do teste L-B (+) e CCD (+). Os testes para flavonoides e polifenóis (Shinoda e FeCl3) foram negativos para esses extratos. Os espectros de absorção no IV de S1, S2 indicaram presença de bandas características de anéis aromáticos, função O-H de álcoois ou fenóis e N-H de aminas; os espectros no IV de S3 mostrou bandas características de éster de ácido graxo com esteroide ou TTPC. Além disso, o teste L-B(+) para esses sólidos, confirmou a presença de núcleo triterpênico na amostra S3.
Agradecimentos
Os autores agradecem a UEFS e UESB pelo incentivo e suporte para a realização dessa pesquisa e a CAPES pelo apoio financeiro.
Referências
BARBOSA, L. C. A. Espectroscopia no infravermelho: na caracterização de compostos orgânicos. 1ª ed. Viçosa: UFV, 2013. 189 p.
FREIRE, F. M. (2012). Aspectos taxonômicos de fungos entomopatógenos (Cordyceps s. l.) da Mata Atlântica Catarinense. Trabalho de Conclusão de Curso (Universidade Federal de Santa Catarina).
FREIRE, F. M. (2015). Taxonomia e distribuição de Ophiocordyceps dipterigena (Ophiocordyceptaceae, Hypocreales). Dissertação Mestrado (Universidade Federal de Santa Catarina).
MATOS, F. J. A. Introdução à Fitoquímica Experimental. 3ª ed. Fortaleza: Edições UFC, 2009. 150 p.
SASAKI F. et al. Relationship between intraspecific variations and host insects of Ophiocordyceps nutans collected in Japan. Mycoscience. 53, p. 85-91, 2012.
SILVERSTEIN, R. M.; BASSLER, G. C.; MORRIL, T. C., Identificação Espectrométrica de Compostos Orgânicos. 6a ed.; LTC Editora: Rio de Janeiro, 2000.
XIANG L., et al. DNA barcoding the commercial Chinese caterpillar fungus. FEMS Microbiology Letters. 347, p. 156-162, 2013.
































