Estudo químico do extrato hexânico das folhas de Piper klotzschianum Kunth (Piperaceae)
ISBN 978-85-85905-21-7
Área
Produtos Naturais
Autores
Santos Gusmão, A. (UESB) ; Oliveira Silva, A. (UESB) ; Gomes dos Santos, T. (UESB) ; Chagas do Nascimento, J. (UESB) ; Fonseca de Paula, V. (UESB)
Resumo
A espécie Piper klotzschianum, pertencente à família Piperaceae, é comumente utilizada na medicina popular do norte do Espírito Santo para o alívio de dores reumáticas através da infusão de suas raízes, caules e folhas em frascos de álcoois comerciais. Neste trabalho, utilizando técnicas usuais de separação, foi possível isolar do extrato hexânico das folhas de Piper klotzschianum, uma mistura de três isômeros: isoasarona, cis-asarona e trans- asarona; as quais foram identificadas através de técnicas de Ressonância magnética nuclear de 1H e 13C, além do uso do CG-EM. A atividade tóxica do extrato etanólico e da mistura isomérica, frente à Artemia salina foi avaliada. O extrato etanólico apresentou atividade moderada, enquanto que a mistura de isômeros apresentou elevada atividade tóxica.
Palavras chaves
Piper klotzschianum; fitoquímica; asarona
Introdução
A família Piperaceae é uma das maiores dentre as Angiospermas basais, somando aproximadamente 3000 espécies (BORNSTEIN, 1989). Segundo Jaramillo et al. (2004), a família Piperaceae está dividida em cinco gêneros: Macropiper, Zippelia, Piper, Peperomia e Manekia. No Brasil são encontradas aproximadamente 500 espécies (YUNCKER, 1974), dos cinco gêneros supracitados os três últimos se encontram presentes no território brasileiro, distribuídos principalmente nas florestas Amazônica e Atlântica (MONTEIRO & GUIMARÃES, 2008). Algumas espécies do gênero Piper já possuem algumas atividades biológicas comprovadas como, inseticida (YANG et al., 2002), larvicida (PARK et al., 2002), adipogênica (ZHANG et al., 2008), fungicida (SILVA & BASTOS, 2007), citotóxica (AVELLA & MOTTA, 2010), dentre outras. Em busca da descoberta de novos fármacos, as pesquisas na área da Química dos Produtos Naturais estão sendo direcionadas para isolamento e identificação de princípios ativos com as mais variadas atividades biológicas. Com uma flora muito diversificada, é importante o estudo fitoquímico de espécies predominantemente brasileiras e que possuem poucos relatos na literatura, como a Piper klotzschianum; essa espécie é utilizada na cidade de Aracruz, norte do Espirito Santo, para alívio de dores reumáticas através da infusão de suas raízes, caules e folhas em frascos de álcoois comerciais; sua aplicação se dar diretamente no local da dor. Este trabalho teve como objetivo o estudo fitoquímico do extrato hexânico das folhas de P. klotzschianum e a avaliação do efeito de toxicidade do extrato etanólico e da fração obtida, frente à Artemia salina.
Material e métodos
Estudo fitoquímico: as folhas de P. klotzschianum (281,85 g), coletadas em Aracruz-ES, foram submetidas à extração a frio em etanol por 7 dias, em seguida o solvente foi removido em evaporador rotatório sob pressão reduzida, sendo obtido 19 g do extrato etanólico, o qual foi codificado como EEFPK. O EEFPK foi submetido a um fracionamento em coluna de vidro, utilizando como fase estacionária a sílica gel, para obtenção dos extratos hexânico, diclorometânico, de acetato de etila e metanólico. Posteriormente, o extrato hexânico (16,02 g), codificado como EHFP, foi incorporado em sílica gel e eluído em uma mistura de hexano/acetato de etila em gradiente crescente de polaridade, obtendo-se 18 frações. Após análise em CCD, a fração EHFP1-2 (1 g) foi purificada em cromatografia em coluna (CC), a qual foi eluída em hexano/acetato de etila em ordem crescente de polaridade, obtendo-se 18 subfrações. A subfração EHFP 2-14 (130,9 mg) foi purificada por CC, utilizando como sistema eluente hexano/diclorometano (6:4), obtendo-se 8 subfrações. Destas, verificou-se que EHFP 3-3 (34,5 mg) apresentava-se pura, após análise por CCD. A amostra EHFP 3-3 foi analisada em CG-EM e RMN de 1H e 13C para auxiliar na elucidação estrutural. Atividade de toxicidade: foi feito o teste de atividade de toxicidade frente à Artemia salina, da fração EHFP3-3 e do EEFPK. Dez larvas recém eclodidas de A. salina foram adicionadas em cada um dos 6 frascos, contendo as soluções de EHFP 3-3 e de EEFPK, com as seguintes concentrações: 5; 10; 20; 30; 50 e 100 µL/mL. As análises foram realizadas em triplicatas. Os frascos foram mantidos sob iluminação e as larvas sobreviventes contadas após 24 e 48h, estas foram considerados mortas caso não exibissem nenhum movimento durante 10 segundos de observação.
Resultado e discussão
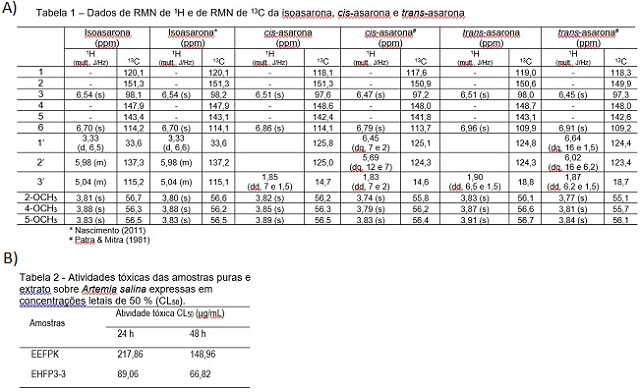
Observando o cromatograma da fração EHFP 3-3 (Figura 1a), nota-se que a mesma
se trata de uma mistura de três substâncias, as quais tiveram suas estruturas
elucidadas por meio dos dados obtidos de RMN 1H e 13C (Figura 2a) e por
comparação com os dados descritos na literatura (NASCIMENTO, 2011; PATRA &
MITRA, 1981), por meio dos quais se pode chegar a conclusão de que estas três
substâncias se tratam dos isômeros: isoasarona, cis-asarona e trans-asarona
(Figura 1b). A isoasarona trata-se de um componente volátil pertencente à
classe dos fenilpropanóides e já foi isolada por Nascimento (2011) no extrato
hexânico das raízes da espécie P. klotzschianum e identificada no óleo
essencial das folhas desta mesma planta. Já a cis-asarona e trans-asarona, que
são também compostos voláteis, foram identificados por Autran et al. (2009)
como componentes majoritários do óleo essencial das folhas e caules da espécie
Piper marginatum. Para a espécie estudada neste trabalho, estas duas
substâncias estão sendo relatadas pela primeira vez. A toxicidade de EFHP 3-3
e EEFPK frente A. salina foi avaliada considerando a CL50 (concentração letal
de 50% das larvas), o EEFPK apresentou atividade tóxica moderada, com CL50 de
217,86 μg/mL (após 24h de exposição da amostra) e CL50 de 148,96 μg/mL (após
48 horas de exposição da amostra). Já a fração EHFP3-3 teve uma elevada
atividade tóxica, com CL50 de 89,06 μg/mL (após 24h de exposição da amostra) e
CL50 de 66,82 μg/mL (após 48h de exposição da amostra), como consta na Figura
2b.

Conclusões
Através da prospecção fitoquímica do extrato hexânico das folhas da P. kloztschianum foram isolados uma mistura das substâncias: isoasarona, cis- asarona e trans-asarona; sendo as duas últimas relatadas pela primeira vez nesta espécie. A mistura isomérica apresentou consideráveis valores de CL50 frente à Artemia salina em análises de 24 e 48 horas. As investigações realizadas neste estudo contribuem para o aumento de informações acerca dos constituintes químicos e de atividades biológicas da espécie estudada.
Agradecimentos
Agradecimentos expressos à CAPES pela concessão da bolsa, a FAPESB pelo fomento da pesquisa, à UFBA e à UESB.
Referências
AUTRAN, E. S.; NEVES, I. A.; DA SILVA, C. S. B.; SANTOS, G. K. N.; DA CÂMARA, C. A. G.; NAVARRO, D. M. A. F. Chemical composition, oviposition deterrent and larvicidal activities against Aedes aegypti of essential oils from Piper marginatum Jacq. (Piperaceae). Bioresource Technology, v.100, p.2284–2288, 2009.
AVELLA, E.; MOTTA, J. R. Main constituents and cytotoxic activity of the essential oil of Piper artanthe. Chemistry of Natural Compounds, v.46, n.4, p.651-653, 2010.
BORNSTEIN, A.J. Taxonomic studies in the Piperaceae. I. The pedicellate pipers of Mexico and Central America. Journal of the Arnold Arboretum, v.70, n.1, p.1-55, 1989.
JARAMILLO, M. A.; MANOS, P. S.; ZIMMER, E. A. Phylogenetic relationships of the perianth-less Piperales: reconstructing the evolution of floral development. International Journal of Plant Sciences, v.165, n.3, p.403-416, 2004.
MONTEIRO, D.; GUIMARÃES, E. F. FLORA DO PARQUE NACIONAL DO ITATIAIA – BRASIL: Peperomia (PIPERACEAE). Rodriguésia, v.59, n.1, p.161-195, 2008.
NASCIMENTO, J. C. “Estudo Químico e Avaliação Biológica De Piper klotzschianum Kunth (Piperaceae) e Croton grewioides Baill (Euphorbiaceae)”. Tese de Doutorado. Universidade Federal da Bahia. 2011.
PARK, I. K.; LEE, S. G.; SHIN, S. C.; PARK, J. D.; AHN, Y. J. Insecticidal and acaricidal activity of pipernonaline and piperoctadecalidine derived from dried fruits of Piper longum L. Journal of Agricultural and Food Chemistry, v.50, n.7, p.1866-1870, 2002.
PATRA, A; MITRA, A. K. Constituents of Acorus calamus: structure of acoramone. Carbon-13 NMR spectra of cis- and trans-asarone. Journal of Natural Products, v. 198, n. 44, p. 668-669, 1981.
SILVA, D. M. M. H.; BASTOS, C. N. Atividade Antifúngica de Óleos Essenciais de Espécies de Piper Sobre Crinipellis perniciosa, Phytophthora palmivora e Phytophthora capsici. Fitopatologia Brasileira, v.32, n.2, p.143-145, 2007.
YANG, Y. C.; LEE, S. G.; LEE, H. K.; KIM, M. K.; LEE, S. H.; LEE, H. S. A Piperidine Amide Extracted from Piper longum L. Fruit Shows Activity against Aedes aegypti Mosquito Larvae. Journal of Agricultural and Food Chemistry, v.50, n.13, p.3765-3767, 2002.
YUNCKER, T.G. The Piperaceae of Brazil. III: Peperomia; Taxa of uncertain status. Hoehnea, v.4, p.71-413, 1974.
ZHANG, H.; MATSUDA, H.; NAKAMURA, S. YOSHIKAWA, M. Effects of amide constituents from pepper on adipogenesis in 3T3-L1 cells. Bioorganic & Medicinal Chemistry Letters, v.18, n.11, p.3272–3277, 2008.
































