Screening fitoquímico de uma espécie de Chamaecrista sp. e avaliação qualitativa da atividade antioxidante via HPTLC
ISBN 978-85-85905-21-7
Área
Produtos Naturais
Autores
Reis, J.D.E. (UEPA) ; Pinheiro, W.B.S. (UFPA) ; Pinheiro Neto, J.R. (UFPA) ; Gomes, P.W.P. (UFPA)
Resumo
Este trabalho objetivou realizar um screening fitoquímico do extrato de uma espécie de Chamaecrista sp., por meio de análise em HPTLC visando à determinação das principais classes de metabólitos secundários existentes, bem como a existência de atividade antioxidante. Os testes revelaram à presença de taninos e flavonoides, este último, possivelmente está correlacionado à ação antioxidante, evidenciado com o método de captura do radical livre DPPH em CCD. Tais resultados podem ser utilizados futuramente para estudos de identificação e isolamento das substâncias que possam ser aplicadas no desenvolvimento de fármacos.
Palavras chaves
Análise fitoquímica; Metabólitos Secundários; Atividade antioxidante
Introdução
O metabolismo pode ser definido como o conjunto de transformações orgânicas que promovem o aproveitamento de nutrientes necessários à continuidade do estado organizado das células. No caso das células vegetais, o metabolismo costuma ser dividido em primário e secundário (MARZZOCO; TORRES, 2007). Os metabólitos primários possuem função estrutural, plástica e de armazenamento de energia, já os metabólitos secundários, produtos secundários ou produtos naturais, aparentemente não possuem relação com crescimento e desenvolvimento da planta (TAIZ; ZEIGER, 2006). No entanto, muitas dessas substâncias destacam-se na área da farmacologia devido a seus efeitos biológicos sobre a saúde da espécie humana (SIMÕES et al., 2007). As principais classes de metabólitos secundários são: flavonóides, alcalóides, cumarinas, agliconas, antraquinonas, triterpenos e/ou esteróides, saponinas, polifenóis e taninos. A planta estudada foi uma espécie de Chamaecrista sp. pertence à família Fabaceae e à subfamília Caesalpinioideae, do mesmo gênero da Chamaecrista nictitans, que segundo Mateos-Martín et al. (2014) encontram-se proantocianidinas, uma classe de polifenóis responsáveis por sua atividade antiviral, mais especificamente, contra o Vírus Herpes Simplex (HSV). A partir destes dados, este trabalho objetivou realizar um screening fitoquímico do extrato de Chamaecrista sp., por meio de análise por HPTLC, visando à determinação das principais classes de metabólitos secundários presentes nesta espécie vegetal, bem como seu potencial antioxidante.
Material e métodos
O material vegetal da Chamaecrista sp. foi coletado na região litorânea do município de Salvaterra-PA e encaminhado ao Laboratório Interdisciplinar de Ciências do Campus XIX (UEPA). Posterirormente, as folhas da espécie pesquisada foram submetidas a secagem em estufa à temperatura de 40ºC (±0,5) por um período de três dias e trituradas em um microprocessador Wallita®. A extração do material triturado foi realizada por maceração em etanol, permanecendo em repouso a temperatura ambiente por 4 dias, após o etanol foi filtrado e evaporado em uma cabine de exaustão. Esse procedimento foi realizado por 4 vezes, até a obtenção do extrato seco para o teste screnning, feito no Laboratório Central de Extração do Instituto de Ciências Exatas e Naturais da Universidade Federal do Pará (CE/ICEN/UFPA). Os testes fitoquímicos qualitativos de terpenos, taninos, flavonóides e alcalóides foram realizados em um sistema robotizado aplicado a Cromatografia Fina de Alta Performance (HPTLC). Utilizou-se como sistema de eluição, Diclorometano/Metanol/Ác. Fómico 1% (90:10), associado a quatro reveladores específicos: VAS, NP/PEG, FeCl3 e Dragendorff. Foram aplicados inóculos com 25, 50 e 75 µg do extrato (5, 10 e 15 µL de 5.000 ppm) para o perfil fitoquímico e o teste antioxidante, realizado avaliando a atividade sequestradora do radical livre DPPH em CCD.
Resultado e discussão
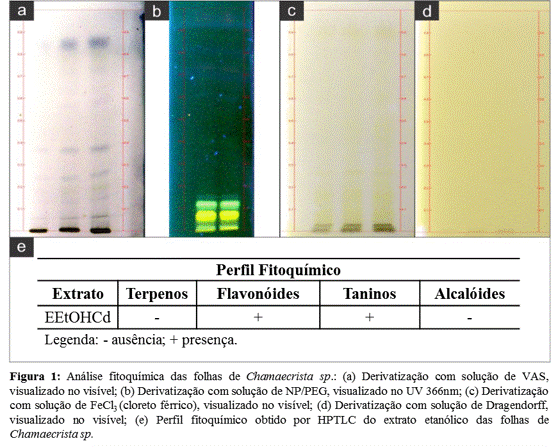
A triagem fitoquímica do extrato etanólico da Chamaecrista sp. evidenciou a
presença de grupos metabólicos de interesse farmacológico, sendo
classificados em positivo e negativo, de acordo com a presença ou ausência
dos mesmos (Figura 1e). O teste com o revelador VAS foi negativo para a
detecção de terpenos ou terpenóides (coloração amarelo-marron), mas resultou
no aparecimento de bandas na cor roxa (Figura 1a), característica de ácidos
graxos (RODRIGUES; SOUZA FILHO; FERREIRA, 2009). A reação para
caracterização de flavonóides foi positiva devido a fluorescência de cor
amarelo-esverdeada evidenciada, com a utilização do revelador NP/PEG (Figura
1b), visualizado no UV 366nm (VILA, 2006). O teste com a solução de FeCl3,
para identificação de taninos, resultou no aparecimento da coloração verde
(Figura 1c), indicando a possível presença de taninos condensados (BARBOSA
et al., 2004). Não foi confirmada a presença de alcalóides (Figura 1d),
visto que não foi observado a formação do precipitado vermelho tijolo, que
caracteriza o metabólito secundário frente ao revelador de Dragendorff
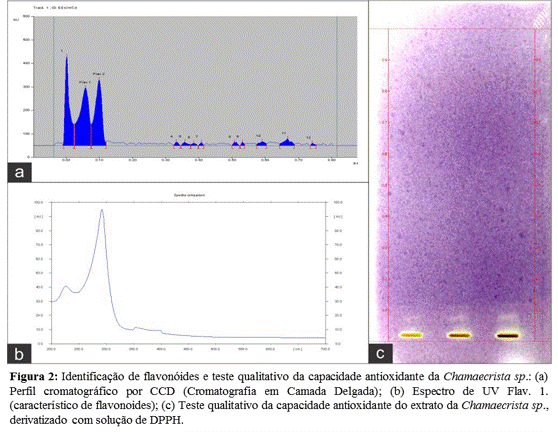
(BARBOSA et al., 2004). Foi possível observar atividade antioxidante para o
extrato da Chamaecrista sp., através da capacidade de sequestro do radical
livre DPPH, resultado do aparecimento de bandas (substâncias) que acabaram
impedindo a oxidação da sílica (Figura 2c). Segundo Nascimento et al.
(2011), este resultado pode esta correlacionado à presença de possíveis
flavonóides, observados nas análises do perfil cromatográfico por CCD e
espectro de UV 320nm (Figura 2a e 2b). Assim, esse promissor potencial pode
ser utilizado para futuros estudos de identificação e isolamento das
substâncias responsáveis por esta atividade.
Conclusões
A triagem fitoquímica qualitativa por HPTLC, possibilitou a visualização de bandas características de flavonóides e taninos no extrato etanólico da espécie Chamaecrista sp.. Além disso, foi possível observar atividade antioxidante, que pode estar correlacionada com a presença de flavonóides, classe que foi evidenciada com o revelador NP/PEG e nas análises do perfil cromatográfico por CCD e espectro de UV 320nm. Portanto, a continuidade dos estudos sobre a espécie se faz necessária, a fim de que seja possível a identificação de moléculas bioativas que sejam aplicadas na produção de fármacos.
Agradecimentos
Agradeço ao professor orientador por ter paciência e bom ânimo para ensinar e ajudar, e à UFPA por disponibilizar o Laboratório Central de Extração.
Referências
BARBOSA, W. L. R.; QUIGNARD, E.; TAVARES, E. C. C.; PINTO, L. N.; OLIVEIRA, F. Q.; OLIVEIRA, R. M. Manual para análise fotoquímica e cromatográfica de extratos vegetais. Revista Cientifica da UFPA. Belém-PA, vol. 4, 2004.
MARZZOCO, A.; TORRES, B. B.. Bioquímica Básica. 3. ed. Rio de Janeiro: Guanabara Koogan, 2007. 736 p.
MATEOS-MARTÍN, M. L.; FUGUET, E.; JIMÉNEZ-ARDÓN, A.; HERRERO-URIBE, L.; TAMAYO-CASTILLO, G.; TORRES, J. L. Identification of polyphenols from antiviral Chamaecrista nictitans extract using high-resolution LC–ESI–MS/MS. Analytical and bioanalytical chemistry, 406 (22), 5501-5506, 2014.
NASCIMENTO, J. C.;, LAGE, L. F. O.; CAMARGOS, C. R. D., AMARAL, J. C.; COSTA, L. M.; SOUSA, A. N.; OLIVEIRA, F. Q. Determinação da atividade antioxidante pelo método DPPH e doseamento de flavonóides totais em extratos de folhas da Bauhinia variegata L. Rev. Bras. Farm. 92(4): 327-332, 2011.
RODRIGUES, I. M. C.; SOUZA FILHO, A. P. S.; FERREIRA, F. A. Estudo fotoquímico de Senna alata por duas metodologias. Planta daninha. Viçosa-MG, vol. 27, n. 3, 2009.
SILVA, G. F. Estudo do potencial biotecnológico de Aniba canelilla (H.B.K) Mez para formulação de cosméticos. Dissertação (Mestrado em Biotecnologia e Recursos Naturais) – Escola Superior de Ciências da Saúde, Universidade do Estado do Amazonas, Manaus, 2012.
SIMÕES, C. M. O.; SCHENKEL, E. P.; GOSMAN, G.; MELLO, J. C. P.; MENTZ, L. A.; PETROVICK, P. R. Farmacognosia: da planta ao medicamento. Florianópolis: Editora da UFSC, 2007. 1102p.
TAIZ, L.; ZEIGER, E. Plant physiology. 4. ed. Sounderland, Massachusetts: Sinauer Associates, 2006. 700 p.
VILA, F. C. Identificação dos flavonoides com atividade antioxidante da cana-de-açúcar (Saccharum officinarum L.). Dissertação (Mestrado em Ciências – Química Analítica), Instituto de Química de São Carlos, Universidade de São Paulo, São Carlos, 2006.
































