LIGAÇÃO COVALENTE: PRATICIDADE NA APLICAÇÃO DOS POSTULADOS DA MECÂNICA QUÂNTICA NO ENSINO DE QUÍMICA.
ISBN 978-85-85905-21-7
Área
Ensino de Química
Autores
Veloz, V. (IFBA) ; Vieira, S. (IFBA) ; Santos, A. (IFBA) ; Rodrigues, R. (IFBA) ; Oliveira, T. (IFBA)
Resumo
Neste trabalho, faz-se o uso da ligação química para o ensino de química sem explicitar diretamente as ferramentas matemática usadas na mecânica quântica. Numa abordagem contextual, explica-se o funcionamento da Teoria da Ligação de Valência (TLV), para compostos covalentes. Salienta-se que, por meio desta teoria baseada nas resoluções das funções de onda, é possível entender a formação dos compostos e sua geometria de forma.
Palavras chaves
Ensino de Química; Ligação Covalente; Teoria de Ligação
Introdução
Com o êxito da mecânica quântica em explicar a estrutura e o comportamento da matéria no início do século XX, os físicos e filósofos das ciências passaram a asseverar que a química poderia ser completamente reduzida à física (BEJARANO, N. et. al., 2013). Contudo, todo tratamento matemático utilizado para essa redução é complexo. Assim, é necessário o uso de aproximações que tornem o entendimento de fácil acesso a quem queira deduzir o comportamento das substâncias químicas. Segundo Dirac (1927), é necessário a existência de “métodos práticos aproximados” em sua famosa citação: “As leis físicas fundamentais necessárias para a teoria matemática de uma grande parte da física e da totalidade da química são completamente conhecidas, a dificuldade é somente que a aplicação dessas leis leva a equações que são muito complicadas de serem resolvidas. Por isso, torna-se desejável que sejam desenvolvidos métodos práticos aproximados de aplicação da mecânica quântica que possam levar a uma explicação das características principais dos sistemas atômicos complexos sem tanta computação”. (DIRAC, P., 1927 apud BEJARANO, N. et. al., 2013, p. 1257). Hoje, estas aproximações baseadas na mecânica quântica estão disponíveis e conseguem explicar de forma satisfatória uma grande quantidade de fenômenos químicos. Estas teorias são importantes pois, no ensino de química, seja na formação básica ou no ensino superior, possibilita o entendimento de todos estes fenômenos a nível didático. Viabilizando assim, o ensino eficiente da química em todas as esferas do ensino sem a necessidade de todo o tratamento matemático complexo.
Material e métodos
A produção desse trabalho foi desenvolvido no componente curricular de Física do curso de Licenciatura de Química do Instituto Federal da Bahia (IFBA) com o objetivo de desenvolver um trabalho que correlacionasse a física com a química. O tema escolhido foi “Defender o uso da Teoria da Ligação de Valência para o Ensino de Química”. Tal teoria permite compreender a formação da ligação química. Enquanto os aspectos matemáticos da resolução da equação de Schrödinger e sua interpretação exigem uma base densa de cálculo, a TLV permite a interpretação dos resultados de forma mais “suave”. Isto possibilita tanto aos discentes do curso superior quanto aos estudantes do ensino médio descrever e explicar fenômenos e propriedades dos materiais de forma satisfatória, sem a necessidade do tratamento físico- matemático exigido pela mecânica quântica.
Resultado e discussão
Apropriando-se da mecânica quântica, a TLV busca explicar a formação do
composto covalente a partir do compartilhamento de elétrons do nível de
valência de átomos diferentes pela sobreposição de suas nuvens eletrônicas.
Neste compartilhamento, somente os elétrons de valência estão disponíveis
para a formação da ligação pois, a carga nuclear efetiva não permite que
elétrons de níveis de energia inferiores participem da formação do composto.
Na ligação, recorre-se a duas etapas hipotéticas: excitação dos elétrons
emparelhados e hibridação dos orbitais do nível de valência. A hibridação é
o termo aplicado para descrever a fusão de nuvens eletrônicas de um átomo
para gerar outras nuvens eletrônicas de energias distintas das quais lhe
deram origem. Tomaremos como exemplo a hibridização de nuvens sp3 do átomo
central do metano (CH4).
Observa-se que o carbono possui apenas dois elétrons desemparelhados, Figura
1.a, o que permite a formação de duas ligações com hidrogênios. Para
explicar a formação do CH4 podemos excitar eletronicamente os elétrons
emparelhados no orbital 2s para um dos orbitais 2p. Após a promoção, Figura
1.b, é apreciado a tetravalência do carbono, as nuvens eletrônicas s e p
ainda possuem ângulos entre ligações diferentes da sua geometria molecular,
109,5°. Por consequente, a TLV utiliza híbridos hipotéticos, Figura 1.c,
formados a partir da fusão do orbital s e três orbitais p, gerando o orbital
sp3 equivalente em energia. Na molécula, estes novos orbitais se orientam
para a formação do tetraedro onde haverá a aderência por parte das nuvens
eletrônicas dos átomos de hidrogênio.
Desse modo, a TLV consegue explicar satisfatoriamente a formação das
ligações covalentes, sua geometria e é o ponto de partida para o
entendimento das interações intermoleculares.
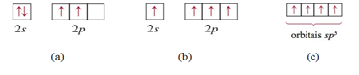
Figura 1- Etapas para formação do Composto.
Conclusões
A partir dos fatos, a TLV consegue explicar satisfatoriamente a formação e geometria dos compostos químicos. Tudo isto sem apresentar explicitamente o tratamento matemático exigido para a interpretação dos dados a partir da resolução das funções de onda na física. Porém, este tipo de representação possuem limitações, por exemplo na TLV, não é possível saber se a substância é diamagnética ou paramagnética, sendo necessário recorrer a outro modelo de ligação. Assim, o modelo não substitui o estudo da mecânica quântica, mas permite o ensino em outra área.
Agradecimentos
Agradeço à Deus, aos meus amigos e colegas de curso, a minha orientadora, o Instituto Federal da Bahia (IFBA) e minha família por estarem sempre do meu lado.
Referências
PENHA, A. F. SILVA, J. L. P. B. Conceito de Ligação Química numa Abordagem Contextual. Universidade do Estado da Bahia Salvador, 2011.
DUARTE, H. A. Ligação Iônica, Covalente e Metálica. Química Nova na Escola. n°4, 2001.14-23 p.
MUNIZ, S. BAGNATO, V. Noções gerais de Física Atômica e Ligações Químicas. USP/ UNIVESP. São Paulo, 2012.
BEJARANO, N. EICHLER, M. L. LABARCA, M. Química e Filosofia: Rumo de uma Frutífera Colaboração. Química Nova. n° 8, 2013.1256-1266 p.
CHANG, Raymond. Química Geral: Conceitos essências. 4. Ed. Porto Alegre: AMGH, 2010, 778 p.
FELDENS, B. DIAS, P. M. C. SANTOS, W. M. S. E Assim se fez o Quantum. Revista Brasileira de Ensino de Física, v. 32, n. 2, 2002.
































