EFEITO DA NATUREZA DO ELETRÓLITO E DA NATUREZA DO ELETRODO NO POTENCIAL DE DESPRENDIMENTO DO HIDROGÊNIO: UM EXPERIMENTO PARA LABORATÓRIO DE GRADUAÇÃO
ISBN 978-85-85905-21-7
Área
Ensino de Química
Autores
Vairolette, L. (FOC) ; Jaimes, R.F.V.V. (UFABC) ; Sousa, I.V. (FOC) ; Agostinho, S.M.L. (IQUSP)
Resumo
O trabalho apresenta uma proposta de experimento para estudantes de graduação em química sobre a reação de desprendimento de hidrogênio por eletrólise. Foi empregada a técnica potenciostatica tendo como eletrodos: cobre (trabalho); platina (auxiliar); prata-cloreto de prata (referência). Verificou-se o efeito termodinâmico sobre o potencial de desprendimento de hidrogênio quando a eletrólise ocorre em meio ácido ou alcalino. Os resultados mostraram que o cobre apresenta efeito cinético em meio alcalino, onde os óxidos de Cu I e Cu II, presentes na sua superfície, tornam o eletrodo menos catalisador do que em meio ácido. A comparação com dados da literatura entre os eletrodos de cobre e de platina platinizada mostra que o eletrodo de cobre é menos catalisador do que a platina em meio ácido.
Palavras chaves
Hidrogênio; Eletrólise; Eletrodo de Cobre
Introdução
A reação de produção do gás hidrogênio, a partir da eletrólise de soluções aquosas, é importante acadêmica e tecnologicamente. É comum o estudante pensar que para realizar a eletrólise é necessário apenas aplicar o potencial da pilha que se opõe à eletrólise, isto é, a formação de água a partir dos gases hidrogênio e oxigênio. No entanto, para que esta reação ocorra, o potencial prático a ser aplicado depende de três termos: o termodinâmico (o potencial de equilíbrio), o elétrico (a queda ôhmica de potencial) e o cinético (a sobretensão para uma determinada corrente aplicada). O objetivo desse trabalho é propor um experimento envolvendo eletrólise, empregando corrente continua, sob controle potenciostático, para verificar o efeito termodinâmico da natureza do eletrólito e o efeito cinético da natureza do eletrodo sobre o potencial de desprendimento do hidrogênio.
Material e métodos
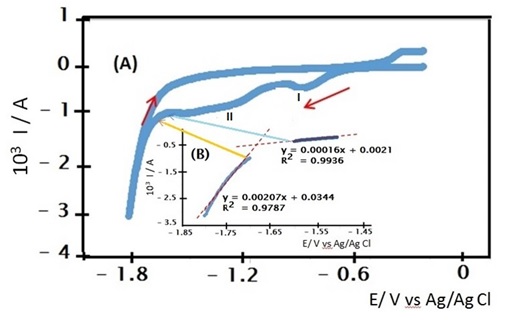
Foram empregadas soluções de ácido sulfúrico 1,0 mol.L-1 e hidróxido de sódio 1,0 mol.L-1. Nas medidas potenciostaticas foram usados três eletrodos: um disco de cobre com cerca de 0,5 cm2 de área, como eletrodo de trabalho, uma chapa de platina, utilizada como eletrodo auxiliar e o eletrodo de prata/cloreto de prata (Ag/AgCl, KClsat), como eletrodo de referência. Foi empregado um béquer de 100 mL como célula eletrolítica. Para a curva de polarização catódica se empregou um potenciostato microAutolab tipo III/FRA 2 acoplado a um microcomputador. Antes das curvas de polarização serem feitas, foram medidos os potenciais de circuito aberto do eletrodo de trabalho em relação ao eletrodo de referência para se determinar o potencial de circuito aberto estacionário (Eca). A velocidade de varredura empregada foi de 1 mV.s-1. A partir do potencial de circuito aberto estacionário, Eca, levantaram-se curvas de polarização catódica, em meios de ácido sulfúrico 1mol.L-1 e de hidróxido de sódio 1mol.L-1. A varredura de potencial, no sentido negativo, se estendeu desde o Eca até o valor de -1,8 V/Ag/AgCl seguida de uma varredura em sentido anódico, isto é, na direção de potenciais positivos desde -1,8 V/Ag/AgCl até o potencial de circuito aberto estacionário. Para determinar o potencial de desprendimento do hidrogênio, o cálculo utilizado foi através de duas retas, onde foram usados dez pontos antes e dez pontos depois do desprendimento de hidrogênio, que foi considerado o início de elevação (em módulo) da corrente na curva de polarização catódica.
Resultado e discussão
Na figura 1 se apresenta a curva de polarização do eletrodo de cobre em meio
de NaOH 1,0 mol.L-1. Para determinar o potencial de desprendimento do
hidrogênio, o cálculo utilizado foi através da intersecção de duas retas,
onde foram usados dez pontos antes e dez pontos depois do desprendimento de
hidrogênio, que foi considerado o início de elevação (em módulo) da corrente
na curva de polarização catódica, depois da redução do óxido cúprico. Um
procedimento análogo foi utilizado na curva de polarização em meio ácido,
onde não se detecta a presença de óxidos superficiais e apenas a redução de
oxigênio do ar e o desprendimento de hidrogênio.
Em meio ácido, na escala do eletrodo Ag/AgCl/KClsat o potencial
termodinâmico do eletrodo de hidrogênio deveria ser -0,199 V. O valor – 0,66
V indica que sobre eletrodo de cobre a reação é mais lenta do que sobre
platina/platinizada, escolhida para o eletrodo padrão de hidrogênio.
O potencial prático observado, em meio alcalino, foi igual a – 1,70V. A
diferença entre os dois valores obtidos neste trabalho em meio alcalino e em
meio ácido é igual a -1,04V. Se o deslocamento fosse apenas termodinâmico,
essa diferença deveria dar -0,83V. A diferença maior pode ser atribuída a
presença de óxido de cobre na superfície desse metal em meio alcalino, sendo
um catalisador menos efetivo que o cobre, em outras palavras, a diferença
maior, em módulo, se deve ao efeito cinético.
Conclusões
Os cálculos termodinâmicos mostram que em meio ácido o eletrodo de cobre não é tão bom catalisador quanto ao de platina platinizada. Os óxidos de cobre presentes em sua superfície mostram que em meio alcalino o potencial de desprendimento de hidrogênio é mais negativo do que o esperado termodinamicamente sugerindo que o cobre metálico, presente em meio ácido, é melhor catalisador do que o cobre contendo óxidos em sua superfície. Sob o ponto de vista de ensino de eletroquímica sugere-se que o experimento seja aplicado em disciplinas de físico-química ou de eletroquímica em cursos de graduação.
Agradecimentos
A fundação de amparo a pesquisa do estado de São Paulo, FAPESP.
Referências
[1] BROTTO, M. E. e IHA, K. “O comportamento eletroquímico do cobre em soluções de hidróxidos”. Anais Assoc. Bras. Quím., 45 (2): 73-96, 1996
[2] INADA, E., Dissertação de Mestrado, FOUSP, 2013
[3] Villamil, R. F. V.; Corio, P.; Rubim, J. C.; Agostinho. S. M. L. – “Effect of sodium dodecylsulfate on copper corrosion in sulfuric acid media in the absence and presence of benzotriazole” – Journal of Electroanalytical. Chemistry., 1999, 472, pp. 112-119.
































