Adsorção de íons de cromo pela Base de Schiff N,N-bis(salicilaldeído)-etilenodiamina solubilizada em clorofórmio.
ISBN 978-85-85905-21-7
Área
Físico-Química
Autores
Adão, J.R.U. (UNIVALI) ; Fischer, A.C.K. (UNIVALI) ; Almerindo, G.I. (UNIVALI)
Resumo
A presença de íons Cromo em efluentes industriais é uma preocupação constante, pois estes são nocivos ao meio ambiente. (ZAYED; TERRY, 2002; PETTINE; CAPRI, 2005; NAMGUNG et al., 2014). Uma possibilidade em potencial como nova alternativa para tratamento de efluentes seria a aplicação de Bases de Schiff como adsorventes, visto que possuem a capacidade de formar complexos com íons metálicos (QUAN et al., 2002), objetivo principal deste trabalho. Aplicou-se Salén solubilizado em clorofórmio visando à remoção dos íons de cromo de um efluente sintético. Observou-se uma redução de 14% no valor da absorbância da solução após a adsorção dos íons cromo. A razão entre a massa de cromo adsorvida e a massa da Base de Schiff foi relativamente baixa, porém a metodologia de trabalho deve ser otimizada.
Palavras chaves
Base de Schiff; Adsorção; Cromo
Introdução
Métodos convencionais de tratamento de efluentes com íons metálicos, como filtração, troca iônica, tratamento eletroquímico e outros, podem muitas vezes tornarem-se inviáveis técnica e/ou economicamente, principalmente quando os metais estão dissolvidos em grandes volumes de efluentes (RODRIGUES et al., 2006). Um dos métodos de tratamento desses efluentes é a adsorção química. Diversos materiais podem ser utilizados como adsorventes de metais, tais como argilas modificadas, carvão ativado, materiais residuais de processos produtivos, polímeros e zeólitas, porém esses adsorventes comuns são de difícil processo de dessorção. Tomando como exemplo o carvão ativado que é largamente utilizado por possuir uma grande área superficial e capacidade de adsorção elevada, não é seletivo e tem um custo relativamente elevado (ARSHADI et al., 2016). Além desse, as zeólitas são adsorventes que sofrem influência do pH e da temperatura do meio (JIMENEZ; DAL BOSCO; CARVALHO, 2004). Diante das desvantagens dos adsorventes atuais, avaliou-se a possibilidade de utilização de um novo adsorvente para o tratamento de efluentes. A aplicação de compostos orgânicos como adsorventes, tais como as Bases de Schiff, é alvo de grande estudo, pois possuem a capacidade de formar complexos com íons metálicos (QUAN et al., 2002). É denominado como Base de Schiff o composto que possui uma dupla ligação entre um nitrogênio e um carbono (ESTEVES-SOUZA et al., 2004). A base N,N-bis(salicilaldeído)- etilenodiamina avaliada nesse trabalho possui em sua estrutura moléculas de oxigênio e nitrogênio, os quais são heteroátomos que agem como centros ativos no processo de adsorção, pois adsorvem na superfície do metal (DAOUD et al., 2014).
Material e métodos
A N,N-bis(salicilaldeído)-etilenodiamina foi sintetizada conforme a metodologia apresentada por Bordini (2000), mediante a reação entre o salicilaldeído (0,5 mol; Sigma Aldrich) e a etilenodiamina (0,5 mol; Alphatec) em metanol sob agitação. Solubilizou-se, em um balão volumétrico, aproximadamente 0,2 g da Base de Schiff em 50 mL de clorofórmio (Dinâmica Química Contemporânea LTDA.) e, em outro balão, preparou-se uma solução aquosa de cloreto de crômio 0,03 M (Aldrich) para utilização como efluente sintético. Em um funil de separação, adicionou-se 40 mL da solução de cloreto de crômio e 25 mL da solução de Salén, agitou-se então manualmente por 5 minutos e aguardou-se a separação das fases heterogêneas (Figura 1) para a coleta da fase orgânica. Em seguida, adicionou-se mais 25 mL da solução de clorofórmio com Base de Schiff e repetiu-se as etapas de agitação e separação. Analisou-se as alíquotas da solução inicial de cloreto de crômio e da solução aquosa de crômio resultante do processo de adsorção em espectrofotômetro, modelo V-630 (JASCO), na região do UV/Visível (λ=610 nm). Quantificou-se o cromo adsorvido através das equações de adsorção dispostas por Chen et al. (2015).
Resultado e discussão
A N,N-bis(salicilaldeído)-etilenodiamina obtida possui aspecto de um sólido
amarelo e teve rendimento bruto de aproximadamente 96%.
Na Figura 1 tem-se a separação das fases do processo antes e após agitação
do funil cuja mudança de coloração da solução com cromo é perceptível.
O Quadro 1 apresenta os dados de absorbância obtidos no espectrofotômetro e
a quantidade de cromo adsorvida por massa de adsorvente, calculada através
das equações citadas anteriormente, onde observa-se uma variação de 14% no
valor da absorbância da solução após a adsorção quando comparada à solução
inicial de cloreto de cromo, o que indica que a solução de clorofórmio com a
base adsorveu parte dos íons de cromo presentes no efluente sintético. A
razão (qt) entre a massa de cromo adsorvida e a massa da Base de Schiff foi
igual a 0,0388 g de adsorbato/g de adsorvente, uma quantidade relativamente
baixa, porém o tempo de contato entre as fases foi de apenas 5 minutos.
Visando a minimização da geração de resíduos, deve-se verificar em estudos
futuros o rendimento de recuperação do clorofórmio após a adsorção e a sua
viabilidade.

Separação das fases heterogêneas do processo de adsorção antes, na esquerda, e após, na direita, a agitação do funil.
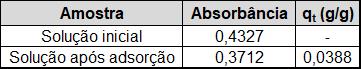
Leituras das absorbâncias das amostras e quantidade de cromo adsorvida.
Conclusões
O método de adsorção utilizado com a N,N-bis(salicilaldeído)-etilenodiamina solubilizada em clorofórmio se mostrou eficaz, porém a metodologia deve ser otimizada para que o tempo de contato do adsorvente com a solução de cloreto de crômio seja maior, aumentando assim a razão entre massa de cromo adsorvida e a massa de adsorvente. Ainda, a síntese da base não dispõe de uma metodologia muito complexa e o rendimento do produto final é alto, então a possibilidade de trabalho é extensa e deve ser explorada. Além desse, outros estudos complementares estão em andamento.
Agradecimentos
À Universidade do Vale do Itajaí e ao Laboratório de Síntese Orgânica pelo suporte físico; Ao professor Doutor Rogério Corrêa pelo apoio.
Referências
ARSHADI, M. et al. Adsorption of methyl orange and salicylic acid on a nano-transition metal composite: Kinetics, thermodynamic and electrochemical studies. Journal Of Colloid And Interface Science, [s. l.], v. 483, p. 118-131, dez. 2016.
BORDINI, J. Síntese e Imobilização do Catalizador [Ru(Salen)(NO)(H2O)]+ em Matrizes Inorgânicas Lamelares. 2000. 95 f. Dissertação (Mestrado) - Curso de Química, Setor de Ciências Exatas, Universidade Federal do Paraná, Curitiba, 2000.
CHEN, T. et al. Adsorption behavior comparison of trivalent and hexavalent chromium on biochar derived from municipal sludge. Bioresource Technology, [s.l.], v. 190, p.388-394, ago. 2015.
DAOUD, D. et al. Adsorption and corrosion inhibition of new synthesized thiophene Schiff base on mild steel X52 in HCl and H2SO4 solutions. Corrosion Science, [s. l.], v. 79, p. 50-58, fev. 2014.
ESTEVES-SOUZA, A. et al. Estudo Experimental e Teórico da Redução de Bases de Schiff Derivadas da 3,3-difenilpropilamina. Química Nova, v. 27, n. 1, p. 72-75, 2004.
JIMENEZ, R. S.; DAL BOSCO, S. M.; CARVALHO, W. A. Remoção de Metais Pesados de Efluentes Aquosos pela Zeólita Natural Escolecita – Influência da Temperatura e do pH Na Adsorção em Sistemas Monoelementares. Química Nova, v. 27, n. 5, p. 734-738, 17 jun. 2004.
NAMGUNG, S. et al. Cr(OH)3+(s) Oxidation Induced by Surface Catalyzed Mn(II) Oxidation. Environmental Science & Technology, [s. l.], v. 48, n. 18, p. 10760-10768, 16 set. 2014.
PETTINE, M.; CAPRI, S. Digestion treatments and risks of Cr(III)–Cr(VI) interconversions during Cr(VI) determination in soils and sediments—a review. Analytica Chimica Acta, [s. l.], v. 540, n. 2, p. 231-238, jun. 2005.
QUAN, Z. et al. Adsorption behaviour of Schiff base and corrosion protection of resulting films to copper substrate. Corrosion Science, [s. I.], v. 44, p. 703-715, 2002.
RODRIGUES, R. F. et al. Adsorção de Metais Pesados em Serragem de Madeira Tratada com Ácido Cítrico. Engenharia Sanitária e Ambiental, Fortaleza, v. 11, n. 1, p. 21 – 26, jan./mar. 2006.
ZAYED, A. M.; TERRY, N. Chromium in the environment: factors affecting biological remediation. Plant And Soil, Holanda, v. 249, p. 139-156, 2002.
































