ESTUDOS QUÍMICO-QUÂNTICOS DE DERIVADOS NAFTOQUINÔNICOS QUE APRESENTAM ATIVIDADES ANTITUMORAIS
ISBN 978-85-85905-21-7
Área
Físico-Química
Autores
Almeida Lira, P.H. (UNIVERSIDADE FEDERAL DE ALAGOAS) ; dos Santos Malta, V.R. (UNIVERSIDADE FEDERAL DE ALAGOAS) ; do Nascimento Silva, J.R. (UNIVERSIDADE FEDERAL DE ALAGOAS) ; Duarte Silva, S.W. (UNIVERSIDADE FEDERAL DE ALAGOAS) ; Correia Vieira, P. (UNIVERSIDADE FEDERAL DE ALAGOAS)
Resumo
O trabalho realizado foi pautado em estudos teóricos de natureza quântica em substâncias pertencentes a classe das naftoquinonas e derivados. Em virtude do número de óbitos provocados por câncer, e tendo em vista que classe estudada apresenta atividades antitumorais, a pesquisa veio propor alterações estruturais que aumentem essas atividades. O cálculo das propriedades eletrônicas e físico-químicas associado aos resultados estruturais fornecidos, possibilitou uma análise da reatividade desses compostos. Através das energias HOMO e LUMO foi possível observar a capacidade doadora e receptora de elétrons, respectivamente. Dentre os derivados estudados, o composto 3 apresentou melhor caráter doador e o 1 melhor caráter receptor.
Palavras chaves
NAFTOQUINONAS; CÂNCER; ATIVIDADE ANTITUMORAl
Introdução
Dados do IBGE, coloca o câncer como sendo a segunda maior causa de mortes no Brasil. Dessa forma, a busca de novos compostos que apresentem atividade antitumoral é importância para evitar o avanço desta doença. As naftoquinonas formam uma importante classe de metabólitos secundários e são encontradas nas plantas de família Bignoniaceae (REICHSTEIN et al, p. 7273– 7284, 2012). Esta classe tem recebido atenção devido a seu potencial de atividade antitumoral (JUNIOR et al, p. 504–508, 2010). Derivados naftoquinonas, por exemplo, a β-lapachona um composto antitumoral potente, são utilizados como protótipos para o desenvolvimento de novas drogas (GARKAVTSEV et al, p. 11596–11601, 2011). As drogas antitumorais utilizadas atualmente para tratar tumores sólidos possuem a estrutura básica das quinonas (KOVACIC et al, p. 658e 668, 2011). No entanto, as doses elevadas necessárias para alcançar o efeito terapêutico e alguns efeitos colaterais observados em pacientes, reforçam a necessidade de se buscar novos medicamentos. O estudo do mecanismo de reação e sua eventual definição implicará em planejamento mais dirigido das sínteses e modificações estruturais de protótipos, que poderá levar à descoberta de novos fármacos. O conhecimento estrutural é fundamental na busca de novas substâncias que atuem em problemas específicos de saúde. Os três compostos selecionados para estudo foram derivados da β-lapachona e foram avaliados em linhagens de câncer: HL-60 (Leucemia promielocítica humana) e SF295 (glioblastoma humano) (JARDIM et al, p. 120, 2015). O presente trabalho tem por objetivo propor alterações estruturais nos compostos em estudo, utilizando a Modelagem Molecular, com objetivo de aumentar suas atividades antitumorais.
Material e métodos
A metodologia consistiu na realização dos cálculos químico-quânticos, utilizando a Modelagem Molecular, com o uso da Mecânica Molecular (aplicando MM+) e Mecânica Quântica, aplicando o método semi-empírico (RM1). Foram feitos cálculos de propriedades físico-químicas, estruturais e eletrônicas, que possam contribuir na análise da relação estrutura-atividade para 3- Hidroxi-2,2-dimetil-5- (2-fenil-hidrazona) -2,3-di-hidronafto [1,2-b] furan- 4 (5H) –ona ( 1), 2,2-Dimetil-5- (2-fenil-hidrazona) -2,3-di-hidronafto- [1,2-b] furan-4 (5H) –ona, ( 2) e 2,2-Dimetil-9- (2-fenil-hidrazona) -2,3- di-hidronafto-[2,3-b] furan-4 (9H) –ona ( 3) (Figura 1). Para tal foi utilizado o programa HyperChem (HyperChemTM, 2017). Propriedades calculadas: Energia de Hidratação (EH), comportamento da molécula em contado com água; Logaritmo de Coeficiente de Partição (Log P), tendência de soluto distribuir-se entre fases líquidas; Refratividade Molar (RM), relacionada com a conformação tridimensional; Polarizabilidade (POL), associada à capacidade com que uma nuvem eletrônica se deforma em um campo elétrico; Massa Molecular (M), Volume (V) e Área Superficial (A), aspectos tridimensionais; Energias Total (ET) e de Ligação (EL), o quanto um composto é estável; Energia Eletrônica (EE) o equilíbrio geométrico; Momento Dipolo (MD), relacionado com a Eletronegatividade (ELET), a capacidade de um composto em atrair elétrons; Energias de HOMO(0) e LUMO(0), medem a capacidade doadora e receptora de elétrons das moléculas, respectivamente; Potencial de Ionização (PI) e Afinidade Eletrônica (AE) que estão relacionadas com energia de HOMO e LUMO, por essa ordem; O Gap, espaço vazio que separa HOMO do LUMO, o quanto os compostos são reativos e/ou estáveis; Dureza (D) e Moleza Absoluta (S).
Resultado e discussão
Analisando os cálculos para os compostos (1,2 e 3), nota-se que o composto 1
apresentou destaque nos valores de suas propriedades. Através EH ( -9,142
Kcal/ mol) observa-se que o mesmo apresenta melhor contado com a água. Este
também possui um melhor resultado para POL, 36.67 Å3, tento assim sua nuvem
eletrônica mais deformada. A RM mostrou-se mais efetiva para este composto.
Tendo este uma estrutura mais estável, de acordo com as EL (-3680,90 Kcal/
mol) e ET ( -95338,32 Kcal/ mol). Tal composto reportou o maior MD (4,63),
que pode ser justificado pelo deslocamento acentuado das cargas, causado
pela a presença de um substituinte mais eletronegativo. O 1 ainda apresentou
uma estrutura geométrica mais estável conforme a EE (-708858,08 Kcal/ mol).
De acordo com a energia do LUMO (-1,10 eV), este apresentou uma melhor
capacidade receptora de elétrons, em concordância com a ELET (4,786). Tal
composto mostrou ser o mais reativo, conforme Gap (7,354). Já o composto 2
reportou ser a estrutura que apresenta maior resistência à deformação, em
conformidade com os valores de Gap (7,39), D (3,69 eV) e S (0,27 eV). O
composto 3 apontou melhores resultados para Log P (2,65), sendo mais solúvel
em água. Este tem a melhor estrutura doadora de elétrons de acordo com a
energia do HOMO (-8,36 eV). Dispondo também da estrutura com menor
facilidade em perder elétrons, de acordo com o PI obtido (8,36). Os
parâmetros estéticos que mostram os aspectos tridimensionais (M, V e A),
também foram analisados, e tais valores relatam que os compostos 2 e 3,
possuem valores de área e volumes bem próximos, fato esse atribuído a
equivalências das estruturas de ambos. Esses também apresentaram uma maior
facilidade em receber elétrons, como mostra os valores da AE,
respectivamente, 0,98 e 1,10 eV.
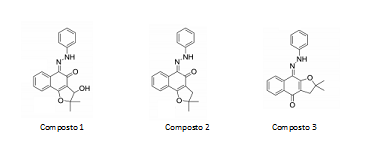
Derivados obtidos da β-LAPACHONA
Conclusões
A pesquisa foi realizada em conformidade com critérios estabelecidos, trazendo assim, resultados plausíveis por meio da química computacional. Os dados obtidos pelo o estudo teórico e os cálculos das propriedades físico-químicas mostraram que a estrutura com o substituinte OH (composto 1) reportou maior reatividade do que os demais compostos. O mesmo se destacou no caráter receptor de elétrons, sendo ainda o que possui a estrutura mais estável. Tento em vista os resultados obtidos, propõe-se que o composto 1 seja o mais indicado para o desenvolvimento a fundo da pesquisa proposta.
Agradecimentos
A UNIVERSIDADE FEDERAL DE ALAGOAS, FUNDAÇÃO DE AMPARO À PESQUISA DO ESTADO DE ALAGOAS E AO CNPQ.
Referências
GARKAVTSEV, I.; CHAUHAN, V. P.; WONG, H. K.; MUKHOPADHYAY, A.; GLICKSMAN, M. A.; PETERSON, R. T.; JAINA, R. K. Dehydro-α-lapachone, a plant product with antivascular activity Proc. Natl. Acad. Sci. U. S. A., v.108, 11596–11601, 2011.
HyperChemTM Molecular Modeling System. Realease 8.0.9 for Windows. USA, 2017
JARDIM, G. A. M.; GUIMARAES, T.T.; PINTO, M. C. F. R.; CAVALCANTI, B.C.; FARIAS, K. M. DE; PESSOA, C.; GATTO, C. C.; NAIR, D.K.; NAMBOOTHIRI, I. N. N.; JUNIOR, E. N. S. Naphthoquinone-based chalcone hybrids and derivatives: synthesis and potent activity against cancer cell lines Med. Chem. Commun., v.6, 120, 2015.
JÚNIOR, E. N. DA SILVA; DEUS, C. F. DE; CAVALCANTI, B. C.; PESSOA, C.; COSTA-LOTUFO, L. V.; MONTENEGRO, R. C.; MORAES, M. O. DE; PINTO, M. C. F. R.; SIMONE, C. A. DE; FERREIRA, V. F.; GOULART, M. O. F.; ANDRADE, C. K. Z.; PINTO, A. V. 3-Arylamino and 3-Alkoxy-nor-β-lapachone Derivatives: Synthesis and Cytotoxicity against Cancer Cell Lines J. Med. Chem., v.53, 504–508, 2010.
KOVACIC, P.; SOMANATHAN, R. Anti-Cancer Agents Med. Chem. v.11, 658e 668, 2011.
PUZYN, T.; SUZUKI, N.; HARANCZYK. M.; RAK J. Calculation of Quantum-Mechanical Descriptors for QSPR at the DFT Level: Is It Necessary? J. Chem. Inf. Model. v. 48, 1174–1180, 2008
REICHSTEIN, A.; VORTHERMS, S.; BANNWITZ, S.; TENTROP, J.; PRINZ ,H.; MULLER, K. Synthesis and Structure–Activity Relationships of Lapacho Analogues. 1. Suppression of Human Keratinocyte Hyperproliferation by 2-Substituted Naphtho[2,3-b]furan-4,9-diones, Activation by Enzymatic One- and Two-Electron Reduction, and Intracellular Generation of Superoxide. J. Med. Chem., v.55, 7273–7284, 2012.
































