Síntese do éster propionato de isoamila catalisada pela enzima Lipozyme 435® em diferentes concentrações de substrato
ISBN 978-85-85905-21-7
Área
Bioquímica e Biotecnologia
Autores
Roesler, B.C.S. (FURG) ; Vanzin, D.C.C. (IFRS) ; Burkert, C.A.V. (FURG)
Resumo
Ésteres de aroma são de grande importância na indústria devido à fragrância e sabor característicos, sendo o éster propionato de isoamila componente de aromas de damasco e abacaxi, do adocicado de amêndoas, bem como de algumas bebidas alcoólicas. O trabalho objetiva avaliar o efeito da concentração de ácido propiônico no percentual de esterificação na síntese do éster propionato de isoamila utilizando a lipase Lipozyme 435®. Com a concentração de ácido 0,2 M, atingiu-se o máximo percentual de esterificação entre as testadas. Entretanto, optou-se por 0,3 M, em que foi possível conciliar a concentração de ácido mais elevada, alto percentual de esterificação e menor tempo. Uma redução no percentual foi observada a 0,5 M, possivelmente associada à desnaturação da enzima em condições ácidas.
Palavras chaves
éster de aroma; esterificação; lipases microbianas
Introdução
Novos métodos para produção de aromas naturais por rotas biotecnológicas foram desenvolvidos nos últimos anos, visto que estes bioprodutos são de grande importância industrial. O mercado mundial que abrange aromas, sabores e fragrâncias espera uma aceleração no consumo, constituindo um segmento atraente e promissor, atingindo um valor de mercado estimado superior a 30 bilhões de dólares no ano de 2017(AKACHA; GARGOURI, 2015; BNDES, 2014). Ésteres de aroma são de grande importância na indústria devido à fragrância e sabor característicos. São responsáveis pela formação e acentuação de aromas nas indústrias de alimentos, cosmética e farmacêutica (SINGH; SAXENA; NAIK, 2014; KHAN; RATHOD, 2015). Os aromas são responsáveis pela identidade de determinado produto e podem ser considerados como ingredientes críticos pelo simples motivo de que, sem a adição destes, os produtos não teriam aceitação. Outros compostos orgânicos, assim como os ésteres, podem ser utilizados como componentes de aroma, como cetonas, álcoois, aldeídos, éteres de fenóis, dentre outros (AKACHA; GARGOURI, 2015; DE BARROS et al., 2012; MACEDO; PASTORE, 1997). Ésteres são compostos orgânicos sintetizados através de reação de esterificação de um ácido carboxílico e um álcool. A reação de esterificação é direta sob a ação de um catalisador em presença ou não de solvente. O uso de enzimas como catalisadores biológicos garantem ao aroma um caráter de produto natural, satisfazendo um público consumidor exigente por sustentabilidade, produtos naturais e livres de químicos. Lipases de origem microbiana são mais amplamente utilizadas na indústria por apresentarem uma produção em menor tempo, por serem de fácil manipulação genética, por proporcionar um aumento na escala de produção e purificação e por sua especificidade e estabilidade (REINEHR et al., 2014). Este trabalho tem por objetivo o estudo da síntese do éster propionato de isoamila com a lipase comercial Lipozyme® 435, avaliando o percentual de esterificação ao longo do tempo em diferentes concentrações de ácido propiônico.
Material e métodos
Enzima:Como biocatalisador para os experimentos foi utilizada a enzima Lipozyme® 435, fornecida pela LNF Latino Americana (Bento Gonçalves - RS - Brasil). Trata-se de uma lipase de Candida antarctica imobilizada em resina acrílica, recombinante, expressa em Aspergillus niger, conforme o fabricante.Síntese do propionato de isoamila:A síntese do éster foi baseada na metodologia para reações de esterificação descrita por Aragão et al. (2009), utilizando frascos de vidro (100 mL) com 40 mL de volume útil contendo ácido propiônico na concentração de 0,06 M, razão molar álcool isoamílico: ácido propiônico de 1:1 e quantidade de enzima definida em 3 g/L. A temperatura indicada para o processo foi de 30ºC, mantida em incubadora rotatória tipo “shaker”, a 180 rpm. As reações foram conduzidas por um período de 48 h. Para o estudo da concentração de ácido propiônico na síntese do éster, foram realizados experimentos nas concentrações de ácido propiônico de 0,06 M, 0,1 M, 0,2 M, 0,3 M e 0,5 M, sendo mantidas as condições de razão molar, quantidade de enzima, agitação e temperatura.Determinação do teor de ácido residual e percentual de esterificação:O teor de ácido propiônico residual foi determinado através da titulação de 1 mL de alíquota, previamente pesada, coletada em diferentes tempos de síntese, sendo diluída em 10 mL de etanol contendo 0,1% de fenolftaleína e titulada com KOH 0,02 N previamente padronizado (ARAGÃO et al., 2011). A determinação do percentual de ácido foi realizada a partir da Eq. (1), adaptada de AOCS (1998). C(%)=V.N.MM/10.W (Eq.1) C é o percentual de ácido carboxílico, V é o volume de KOH gasto na titulação (mL), N é a normalidade do KOH, MM é a massa molar do ácido carboxílico e W a massa correspondente a 1 mL de amostra retirada para titulação (g). O percentual de esterificação foi expresso em percentual molar do ácido consumido, Eq. (2), segundo Oliveira et al. (2000). Percentual de esterificação(%)= (Co-C/Co)x100 (Eq.2) Co é concentração inicial dos ácidos residuais livres no tempo 0 h e C é a concentração dos ácidos residuais livres em um determinado tempo t.Tratamento estatístico dos dados:Os experimentos foram realizados em triplicata. Foi utilizado o teste de Tukey, a 95% de confiança (p<0,05), para verificar a existência de diferenças significativas, utilizando-se o “software” Statistica 5.0 (StatSoft Inc., EUA).
Resultado e discussão
Os resultados obtidos para o percentual de esterificação do éster propionato de isoamila estão apresentados na Figura 1. A melhor condição para concentração de ácido propiônico foi de 0,2 M, atingindo 97,4% de esterificação para um tempo de reação de 48 h, diferindo significativamente das outras condições testadas. Entretanto, considerando que o aumento da concentração de ácido no meio reacional é interessante, pois representa uma maior concentração de éster produzido, favorecendo sua recuperação, optou-se por selecionar a concentração de 0,3 M, cujo máximo percentual de esterificação foi de 95,2% em 24 h. Apesar do valor do percentual de esterificação ser um pouco menor em relação ao obtido com 0,2 M, o tempo para atingir a máxima conversão foi menor (24 h para 0,3 M e 48 h para 0,2 M), indicando uma maior produtividade. Observa-se ainda que na concentração de 0,5 M o percentual de esterificação sofreu uma drástica redução, significando que a acidificação do meio para concentrações iguais ou maiores que esta provoca uma provável desnaturação ou inibição enzimática, diminuindo a atividade catalítica. Lorenzoni et al. (2012) estudaram a síntese do éster butirato de butila em sistema com presença da lipase Lipozyme® RM IM. Avaliaram o efeito do ácido sobre a atividade enzimática, variando a concentração de 0,1 a 2,0 M. Constatou-se um aumento na velocidade de reação até a concentração de 1,0 M. Uma diminuição na atividade foi observada quando a concentração variou de 1 a 2 M, relacionada a uma possível inibição ou acidificação excessiva do meio. A síntese do éster propionato de isoamila realizada por Krishna e Karanth (2002) resultou em um percentual de esterificação máximo de 93%, para uma razão enzima-substrato de 24 g/mol, concentração de substrato de 1,5 mol/L para um tempo de 24 h.
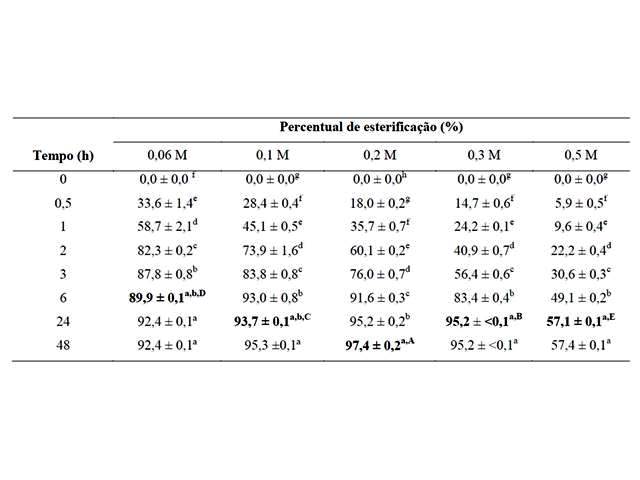
Letras minúsculas iguais: não há diferença entre os tempos de reação; Letras maiúsculas iguais: não há diferença entre os percentuais máximos.
Conclusões
Utilizando concentração de ácido propiônico de 0,2 M, atingiu-se o máximo percentual de esterificação entre as concentrações testadas. Entretanto, estabeleceu-se a concentração de 0,3 M, em que foi possível conciliar concentração de ácido mais elevada (e consequentemente do éster formado), alto percentual de esterificação e menor tempo de reação, sendo que uma redução no percentual de esterificação foi observada a 0,5 M, possivelmente associada à desnaturação da enzima em condições mais ácidas.
Agradecimentos
Os autores agradecem à FURG, CNPq, CAPES e FAPERGS.
Referências
AKACHA, N.B.; GARGOURI, M. Microbial and enzymatic technologies used for the production of natural aroma compounds: synthesis, recovery, modeling, and bioprocesses. Food and Bioproducts Processing, v. 94, p. 675-706, 2015.
AOCS. Official and tentative methods of the American Oil Chemist’s Society, 1998. Disponível em: http://www.aocs.org/Methods/content.cfm?ItemNumber=40798. Acesso em: 12 de mai, 2016, 11:30.
ARAGÃO, V.C; ANSCHAU, A.; PORCIUNCULA, B.D.A.; THIESEN, C.; KALIL, S.J.; BURKERT, C.A.V.; BURKERT, J.F.M. Síntese enzimática de butirato de isoamila empregando lipases microbianas comerciais. Química Nova, v. 32, p. 2268-2272, 2009.
ARAGÃO, V.C; PORTO, M.R.A; BURKERT, C.A.V.; KALIL, S.J.; BURKERT, J.F.M. Response surface methodology approach for the synthesis of ethyl butyrate. Food Technology and Biotechnology, v. 49, p. 103-110, 2011.
BNDES – Banco Nacional do Desenvolvimento (2014). Potencial de diversificação da indústria Brasileira. Relatório 4 – Aromas, sabores e fragrâncias. Disponível em: http://www.bndes.gov.br/SiteBNDES/export/sites/default/bndes_pt/Galerias/Arquivos/produtos/download/aep_fep/chamada_publica_FEPprospec0311_Quimicos_Relat4_aromas.pdf. Acesso em 10 de jun, 2016, 13:30.
DE BARROS, P.C.; AZEVEDO, A.M; CABRAL, J.M.S.; FONSECA, L.P. Optimization of flavour esters synthesis by Fusarium Solani Psi cutinase. Journal of Food Biochemistry, v. 36, p. 275-284, 2012.
KHAN, N.R.; RATHOD, V.K. Enzyme catalyzed synthesis of cosmetic esters and its intensification: a review. Process Biochemistry, v. 50, p. 1793-1806, 2015.
KRISHNA, S.H.; KARANTH, N.G. Response surface modeling of lipase – catalyzed isoamyl propionate synthesis. Journal of Food Science, v. 67, p. 32-36, 2002.
LORENZONI, A.S.G.; GRAEBIN, N.G.; MARTINS, A.B.; FERNANDEZ-LAFUENTE, R.; AYUB, M.A.; RODRIGUES, R.C. Optimization of pineapple flavour synthesis by esterification catalysed by immobilized lipase from Rhizomucor miehei. Flavour and Fragrance Journal, v. 27, p. 196-200, 2012.
MACEDO, G.A.; PASTORE, G.M. Lipases microbianas na produção de ésteres formadores de aroma. Ciência e Tecnologia dos Alimentos, v. 17, p. 115-119, 1997.
OLIVEIRA, P.C; ALVES, G.M.; CASTRO, H.F.; MEI, L.H.I. Síntese do butirato de nbutila empregando lipase microbiana imobilizada em copolímero de estireno-divinilbenzeno. Química Nova, v. 23, n. 5, p. 632-636, 2000.
REINEHR, C. O.; RIZZARDI, J.; SILVA, M.F.; DE OLIVEIRA, D.; TREICHEL, H. COLLA, L.M. Produção de lipases de Aspergillus niger e Aspergillus fumigatus através de fermentação em estado sólido, avaliação da especificidade do substrato e seu uso em reações de esterificação e alcoólise. Química Nova, v. 37, p. 454-460, 2014.
SINGH, P.; SAXENA, D.K.; NAIK, S.N. Synthesis of food flavors by enzymatic esterification process. International Journal of Science and Research, v. 3, p. 2113-2116, 2014.
































