Purificação e caracterização de diferentes isoformas de tripsina a partir do intestino do Scomber scombrus, através de fracionamento comparativo com diferentes solventes orgânicos
ISBN 978-85-85905-21-7
Área
Bioquímica e Biotecnologia
Autores
Victor dos Santos, C.W. (UFAL) ; Ribeiro Cardoso dos Santos, D.M. (UFAL) ; Barros de Souza, C. (UFAL) ; Sarmento de Albuquerque, F. (UFAL) ; de Araújo Tenório, H. (UFAL) ; da Costa Marques, M.E. (UFAL) ; Pereira Silva, T. (UFAL) ; Vieira Pereira, H.J. (UFAL)
Resumo
Estudos destinados a purificação de enzimas extraídas a partir dos subprodutos da atividade pesqueira se mostram de grande importância, tendo como principal meta emprego de todo o conteúdo em massa do animal a fins lucrativos, e ao mesmo tempo, dispor no mercado, moléculas proteolíticas com características bioquímicas mais atrativas. Através dos estudos realizados foi possível purificar por meio de cromatografia líquida em gel filtração, duas isoformas de tripsinas extraídas a partir do intestino do peixe Cavala Scomber scombrus, com valores de recuperação diferenciados (26,32% e 62,4%) mediante fracionamento comparativo com diferentes solventes orgânicos.
Palavras chaves
'Scomber scombrus; 'Tripsina; 'Purificação
Introdução
Assim como qualquer espécie de seres vivos, os peixes necessitam de nutrientes básicos, os quais fomentem energia e metabólitos essenciais às vias catabólicas e anabólicas. Os nutrientes dos alimentos, antes de serem absorvidos, devem passar por processos de digestão e absorção, e estes, por sua vez, dependerão da disponibilidade de enzimas, como a tripsina, quimotripsina e pepsina, as quais podem ser encontradas em locais específicos ao longo do trato gastrintestinal (CHONG et al., 2002; JUN-SHENG et al., 2006; KUMAR et al., 2007). Estas moléculas, são responsáveis pela catálise de diferentes ligações peptídicas em proteínas e peptídeos, agindo em regiões específicas. Tal característica faz das proteases uma classe de enzimas bastante utilizadas em inúmeros processos biotecnológicos, que vão desde a sua utilização na alimentação animal, à produção de fármacos, e incrementos na produção de detergentes e seus derivados. Embora exista uma real demanda em todo o mundo para o aumento no consumo de pecados, a sua comercialização ainda está muito fortemente atrelada a exportação da carne, sendo que as vísceras, por si só, representa 30% do peso bruto do animal, e que além disso, é uma fonte rica de enzimas de elevado valor biotecnológico (FAO-SOFIA, 2004 apud KHALED et al, 2011). Assim, acredita-se que estudos destinados a purificação de enzimas extraídas a partir dos subprodutos da atividade pesqueira se mostram de grande importância, tendo em vista empregar todo o conteúdo em massa do animal a fins lucrativos, e ao mesmo tempo, dispor no mercado, moléculas hidrolíticas com características bioquímicas mais atrativas.
Material e métodos
2.1 Preparação do extrato bruto Após coleta dos materiais cedidos pelos pescadores, foi realizado a preparação do extrato bruto de diferentes regiões do trato digestivo do Scomber scombrus. Para certificação da atividade, realizou-se a medição espectrofotométrica a 410 nm. 2.2 Precipitação induzida por solventes orgânicos e cromatografia líquida O fracionamento foi realizado com dois diferentes solventes orgânicos, acetona e etanol, variando a proporção, v/v, de 0-80%. Posteriormente, avaliou-se a atividade tripsínica para ambas as metodologias. As frações com maiores atividades de hidrólise perante o substrato BApNA foram submetidas a uma coluna cromatográfica Sephacryl S-100, equilibrada com Tris HCl 50 mM pH 8,0 + 0,5 M de NaCl. 2.3 Estabilidade e determinação da atividade ótima em diferentes pHs Para a determinação do pH ótimo foram escolhidos os sistemas tampão: acetato de sódio (pH 4-6); fosfato de sódio (pH 7,0); Tris-HCl (pH 8,0); glicina (pH 9-11) todos à concentração de 100 mM. Para determinação do pH ótimo, as enzimas foram mantidas a 37°C nos diferentes pHs por 60 min. Em se tratando dos testes de estabilidade, a proteína isolada foi incubada por 60 min nos diferentes pHs, a temperatura de 50 °C. 2.6 Teste de inibição A ação catalítica das enzimas foi avaliada na presença de diferentes inibidores: Fluoreto de Fenilmetilsulfonil (PMSF) (1mM), 2-Mercaptoethanol (1mM) e Ácido Etilenodiaminotetracético (EDTA) (1mM) e Benzamidina (1mM). Nesta análise, a enzima foi incubada com os inibidores por 60 min a 25°C, procedendo o teste de atividade como descrito anteriormente. A reação sem a presença de inibidores foi tomada como 100% de atividade.
Resultado e discussão
Ao comparar os extratos preparados para as diferentes regiões do trato
gastrintestinal do animal (Scomber scombrus), verificou-se que o intestino
possuía a maior atividade detectada. As precipitações realizadas, para ambos
os solventes escolhidos mostrou que a tripsina havia sido concentrada numa
única fração, no sobrenadante final, e com valores de recuperação bastante
aproximado, 32,35% para etanol e 35% para o método com acetona. Após o
fracionamento, as enzimas foram purificadas com recuperações estimadas em
26,32% para a metodologia usando etanol (FE), e de 62,4% para enzima
precipitada com acetona (FA).
A validação do método de purificação e a determinação do peso molecular foi
estimada através da eletroforese em SDS-PAGE, onde foi possível estimar a
massa aproximada para as proteínas em 24 KDa.
Os testes de pH e temperatura ótimos mostraram que as enzimas apresentaram
estabilidades em pH 8,0 e 50°C. Além disso, a maior estabilidade foi mantida
em valores de pH alcalinos 8,0-11,0, e a temperaturas abaixo de 40°C.
O ensaio inibitório confirmou ser uma enzima tipo tripsina, com elevada
sensibilidade aos inibidores clássicos das serino proteases. Figura 1.
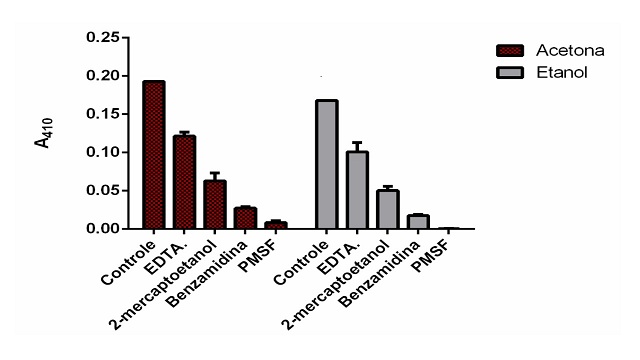
Teste de Inibição: A atividade em pH 8,0 a 50°C por 7 h. A atividade da enzima medida sem a presença do inibidor foi tomada 100%.
Conclusões
Com o estudo proposto foi possível purificar e caracterizar as tripsinas termoestáveis a partir do intestino do Scomber scombrus com apenas dois processos de purificação. As enzimas purificadas mostraram altas atividades ente pHs 6,0-11,0, bem como entre 20-40 °C. Com relação aos estudos bioquímicos realizados, verificou-se que ambas são pertencentes à família das serinoproteases.
Agradecimentos
Os autores agradecem a CAPES, FAPEAL e UFAL.
Referências
ROPPA, L. Perspectivas da produção mundial de carnes, 2007 a 2015. Disponível em: <http://pt.engormix.com/member_login. aspx?referer=yes> Acesso em: janeiro de 2015. 2009.
SIDONIO, L. et al. Panorama da aquicultura no Brasil: desafios e oportunidades. BNDES Setorial, v. 35, p. 421-463, 2012.
CHONG; et al. Partial characterization and activities of proteases from the digestive tract of discus fish (symphysodn aequifasciata). Aquaculture, v. 203, p. 321-333. 2002.
JUN- SHENG; el al. Otogeny of protease, amylase and lipase in the alimentary tract of hibrid juvenile tilapia (Oreochromis niloticus X Oreochromis aureus). Physiol Biochem, V. 32, p. 295-303, 2006.
KUMAR, S; et al. Digestive proteases of three carps catla catla, Labeo rohita and hypophthalmechthys moletrix: partial characterization and protein hidrolysis efficiency. Aquaculture nutrition, v. 13, p. 381-388, 2007.
FAO-SOFIA. The state of world fisheries and aquaculture (SOFIA) 2004. FAO Fisheries Department, Rome tuna (Thunnus albacores) spleen: purification and characterization. Comp Biochem Physiol, 144B:47–56. 2004.
Scomber scombrus Linnaeus, 1758 Atlantic mackerel. Disponível em<http://www.fishbase.org/summary/118> acesso em 22 de lulho de 2017.
































