Construção de plataformas funcionalizadas com fragmentos de DNA para a eletrodetecção direta de Toxoplasma gondii
ISBN 978-85-85905-21-7
Área
Bioquímica e Biotecnologia
Autores
Alves, L.M. (UNIVERSIDADE FEDERAL DE UBERLÂNDIA) ; Rodovalho, V.R. (UNIVERSIDADE FEDERAL DE UBERLÂNDIA) ; Cunha, B.D. (UNIVERSIDADE FEDERAL DE UBERLÂNDIA) ; Segatto, M.S. (UNIVERSIDADE FEDERAL DE UBERLÂNDIA) ; Madurro, J.M. (UNIVERSIDADE FEDERAL DE UBERLÂNDIA) ; Madurro, A.G.B. (UNIVERSIDADE FEDERAL DE UBERLÂNDIA)
Resumo
Neste trabalho foram desenvolvidas duas plataformas visando a imobilização de uma sonda de DNA específica para Toxoplasma gondii e a hibridização usando o oligonucleotídeo complementar. A imobilização da sonda (ToxR1) e a formação da dupla fita do DNA (ToxR1:ToxR2) mostraram boa resposta por detecção direta da oxidação de resíduos de guanina usando voltametria de pulso diferencial. Foi observada uma diminuição de cerca de 15% e 7%, devido à hibridização ToxG1:ToxG2, para AuNP/3-HBA e 3-HBA, respectivamente. Portanto, a plataforma AuNP/3-HBA foi mais eficiente para a hibridização. O biossensor foi seletivo frente a um alvo não específico. Ensaios ópticos foram conduzidos para confirmar a formação da dupla fita do DNA sobre a superfície dos eletrodos modificados.
Palavras chaves
Toxoplasma gondii; Filmes poliméricos; Nanopartículas de ouro
Introdução
Os polímeros condutores têm sido amplamente utilizados no desenvolvimento de biossensores (ATES, 2013; RAHMAN et al., 2015). Os polímeros derivados de ácido hidroxibenzóico são utilizados no desenvolvimento de filmes poliméricos para a modificação de eletrodos devido à presença de grupos funcionais (ácido carboxílico e hidroxilas), que são susceptíveis de sofrer eletropolimerização e interagir com biomoléculas (FERREIRA et al., 2014). Os nanomateriais à base de metais nobres, como as nanopartículas de ouro (AuNPs), têm sido amplamentente investigados devido às suas propriedades distintas, como altas conduções elétricas e térmicas, alta resistência mecânica e elevada área superficial (HAJIHOSSEINI et al., 2016). A detecção de sequências específicas de DNA desempenha um papel importante em muitos campos, especialmente em diagnósticos clínicos. O monitoramento direto de mudanças em suas propriedades eletroquímicas, como a oxidação de resíduos de guanina e adenina, permite a detecção de hibridização na superfície do eletrodo (OLIVEIRA-BRETT et al., 2004). O Toxoplasma gondii é um protozoário parasita intracelular responsável pela toxoplasmose, uma zoonose com importância médica e veterinária em todo o mundo, e o diagnóstico e caracterização genética da infecção por T. gondii são cruciais para o monitoramento, prevenção e controle dessa doença. O objetivo desse trabalho foi comparar duas plataformas para imobilização e hibridização de um oligonucleotídeo específico para Toxoplasma gondii.
Material e métodos
Os estudos eletroquímicos foram realizados em um potenciostato(CH Instruments 620C, EUA). Discos de grafite (6,15 mm de diâmetro, 99,9995% de pureza),placa de platina e prata/cloreto de prata(3,0 mol L-1)foram utilizados como eletrodos de trabalho, auxiliar e referência, respectivamente. Os ensaios utilizando as AuNPs foram realizados utilizando um espectrofotômetro (UV-1650PC, Shimadzu). Os eletrodos de grafite foram polidos mecanicamente (alumina 0,3 μm)e pré-condicionados em solução de 0,5 mol.L-1 HClO4(0,0 e + 1,2 V, 4 ciclos, 50 mV.s-1). Para a eletrodeposição das AuNPs, os eletrodos foram imersos na solução 0,01 mmol L-1 de HAuCl4 preparado em H2SO4 (0.5 mol.L-1)e a redução das AuNPs realizada por cronoamerometria em um potencial fixo de -0,25V. Após a eletrodeposição das nanoparticulas os eletrodos foram modificados com 3-HBA (2,5 mmol.L-1,10 varreduras, 0,0 e +1,2 V vs. Ag / AgCl, 50 mV.s-1). Os oligonucleotídeos foram sintetizados pela Invitrogen Life Technologies (ToxR1 sonda: 5'-CTGGGAACGGTGGGAATGAA-3 ', alvo complementar ToxR2: 5'- TTCATTCCCACCGTTCCCAG-3 ', alvo não complementar: 5'- CCACTCTTCAATTCTCTCCGCC-3'), diluídos em tampão SSC (pH 7,0, NaCl 0,3 mol.L-1 e citrato de sódio 0,03 mol.L-1). As AuNPs foram produzidas usando o método de Turkevich-Frens modificado. Para a sensibilação foram utilizados 2 uL de ToxR1 (200 μmol.L-1) e, a seguir adicionado a 200 μL de solução AuNPs (temperatura ambiente, 1 hora). 2 uL dos alvos (complementares e não complementares, 200 ng.μL-1) foram adicionados e mantidos a 52ºC durante 30 minutos e NaCl saturado foi utilizado para promover a agregação das AuNPs.
Resultado e discussão
A imobilização e hibridização foi monitorada usando o sinal de oxidação do resíduo de guanina, a base nitrogenada mais redox nas cadeias de DNA, quando a hibridização ocorre há uma diminuição nos sinais eletroquímicos devido à interação das guaninas livres da sonda com as bases de citosina complementares presentes na sequência alvo (SOUZA et al., 2011). A Figura 1A mostra que o pico de oxidação do resíduo de guanina ocorre a + 0,96 V vs. Ag / AgCl e uma diminuição dos valores de corrente pode ser observada após a hibridização e quando foi adicionado o alvo não complementar o valor de corrente foi semelhante à sonda. A Figura 1B mostra a imobilização e hibridização sobre as duas superfícies analisadas, 3- HBA e 3-HBA/AuNP, observou-se uma diminuição de cerca de 7% no sinal da guanina devido à hibridização entre a sonda e o alvo específico sobre os eletrodos contendo somente 3-HBA e uma diminuição de cerca de 15% sobre os eletrodos contendo AuNP/3-HBA, indicando que a última se mostrou mais eficiente. A funcionalização de AuNPs com oligonucleotídeo também foi utilizada para análise de hibridização. A Figura 2 mostra o espectro de absorção das AuNPs. O pico de absorbância máxima a 520 nm está de acordo com Verissimo e colaboradores (2016). Como observado na Figura 2d quando a sonda ToxR1 foi incubada com o alvo específico, há uma mudança significativa no pico de absorbância, ampliando e deslocando para um comprimento de onda mais longo e quando foi incubada com o alvo não complemetar (Figura 2c) tanto o pico de absorbância quanto o deslocamento são semelhantes à sonda, indicando que o processo de reconhecimento do alvo complementar ocorre, corroborando com os resultados eletroquímicos.
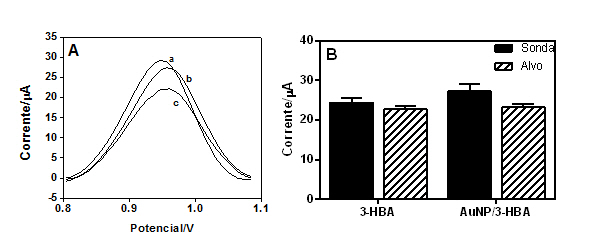
(A) VPD da oxidação da guanina após a imobilização de ToxR1 (a) ToxR1: alvo não complementar (b) ToxR1:ToxR2 (c). (B) Histograma obtido da VPD.
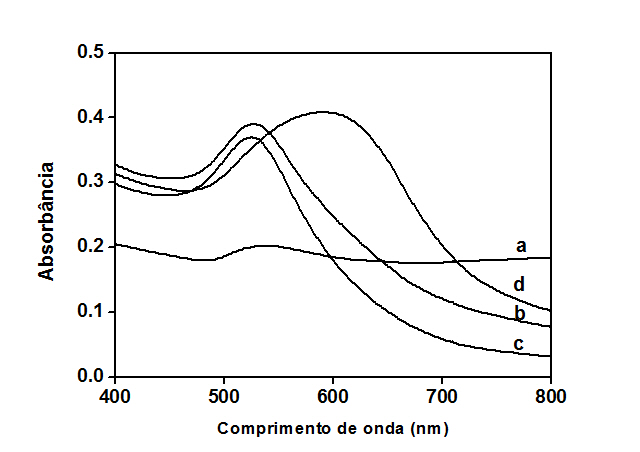
Espectro de absorção na UV-vis de: AuNPs (a), AuNPs/ToxR1/NaCl(b), AuNPs/ToxR1/alvo não específico /NaCl (c)e AuNPs/ToxR1/ToxR2/NaCl (d).
Conclusões
A imobilização de sequência específica para Toxoplasma gondii e a hibridização com o alvo complementar apresentaram boas respostas por detecção direta da oxidação dos resíduos de guanina. A plataforma AuNP/3-HBA mostrou-se mais eficiente para a imobilização da sonda ToxR1 e para a interação (ToxR1:ToxR2). Ensaios ópticos usando nanopartículas de ouro corroboraram com os resultados eletroquímicos.
Agradecimentos
Os autores agradecem ao CNPq, FAPEMIG e CAPES pelo apoio financeiro.
Referências
ATES, M. A review study of (bio)sensor systems based on conducting polymers. Materials Science and Engineering: C – Journal, n. 33, 1853-1859, 2013.
FERREIRA, D.C.; RODRIGUES, L.P; MADURRO, J.M.; MADURRO, A.G.B.; OLIVEIRA,R.T.S.; ABRAHAO, O. Graphite Electrodes Modified with poly(3-hydroxybenzoic acid) for Oligonucleotides Sensors, International Journal of Electrochemical Science, n. 9, 6246-6257, (2014).
HAJIHOSSEINI, S.; NASIRIZADEH, N.; HEJAZI, M.S; YAGHMAEI, P. A sensitive DNA biosensor fabricated from gold nanoparticles and graphene oxide on a glassy carbon electrode. Materials Science and Engineering: C – Journal, n. 61, 506-515, 2016.
OLIVEIRA-BRETT, A.M.; PIEDADE, J.A; SILVA, L.A.; DICULESCU, V.C. Voltammetric determination of all DNA nucleotides. Analytical Biochemistry, n. 332, 321-329, 2004.
RAHMAN, M.M.; LI, X.B.; LOPA, N.S.; AHN, S.J.; LEE, J.J. Electrochemical DNA hybrdization sensors based on conducting polymers. Sensors (Basel), n. 15, 3801-3829, 2015.
SOUZA, E.; NASCIMENTO, G.; SANTANA, N.; FERREIRA, D.; LIMA,M.; NATIVIDADE, E.; MARTINS, D.; LIMA-FILHO, J. Label-free electrochemical detection of the specific oligonucleotide sequence of dengue virus type 1 on pencil graphite electrodes, Sensors (Basel), n. 11, 5616-5629, 2011.
TENTERA, A.M.; HECKEROTHA, A.R.; WEISS, L.M. Toxoplasma gondii: from animals to humans. International Journal for Parasitology, n. 30, 1217–1258, 2000.
VERISSIMO, T.V.; SANTOS, N.T.; SILVA, J.R.; AZEVEDO, R.B.; GOMES, A.J.; LUNARDI, C.N. In vitro cytotoxicity and phototoxicity of surface-modified gold nanoparticles associated with neutral red as a potential drug delivery system in phototherapy, Materials Science and Engineering: C – Journal, n. 65, 199-204, 2016.
































