Bioprodução de Carotenoides: Estratégias de Cultivo em Batelada Alimentada Utilizando Glicerol Bruto
ISBN 978-85-85905-21-7
Área
Bioquímica e Biotecnologia
Autores
Ores, J.C. (FURG) ; Souza, I.L.R. (FURG) ; Pereira, R.N. (FURG) ; Burkert, C.A.V. (FURG)
Resumo
Devido às propriedades biológicas benéficas dos carotenoides microbianos, os mesmos vêm atraindo interesse da indústria alimentícia, farmacêutica e cosmética. Assim, o presente trabalho propõe a produção de carotenoides por batelada alimentada pela levedura oleaginosa Rhodotorula mucilaginosa utilizando glicerol bruto. Diferentes estratégias foram estudadas, variando a composição e quantidade dos pulsos, totalizando seis ensaios. Os cultivos foram realizados em frascos Erlenmeyer, 180 rpm, 25 °C. A batelada com dois pulsos de meio de cultivo (contendo glicerol bruto) em 96 h e 192 h proporcionou um aumento na produção de carotenoides de 48,8%, alcançando uma produtividade de 4,2 µg/L.h, demonstrando o potencial desta levedura como fonte para obtenção de carotenoides microbianos.
Palavras chaves
batelada alimentada; glicerol bruto; carotenoides
Introdução
Com o aumento da produção nacional e mundial do biodiesel, há vários estudos sobre o reaproveitamento do glicerol bruto, como a utilização de micro-organismos oleaginosos para a produção de lipídios e carotenoides (CHATZIFRAGKOU et al., 2011; MACHADO; BURKERT, 2015; SPIER, 2014). O glicerol, ou 1-2-3-propanotriol, é um álcool tri-hidroxilado gerado na produção do biodiesel, sendo que 100 lbs de biodiesel produzidos por transesterificação de óleos vegetais ou animais resultam em 10 lbs de glicerol bruto (KNOTHE et al., 2006; LORA; VENTURINI, 2012). As leveduras oleaginosas são aquelas capazes de acumular lipídios acima de 20% de sua biomassa em base seca, como as pertencentes aos gêneros Yarrowia, Rhodotorula, Cryptococcus, entre outros (LI; DU; LIU, 2008; MENG et al., 2009; PAN et al., 2009). A levedura oleaginosa Rhodotorula mucilaginosa foi isolada pelo grupo de pesquisa do Laboratório de Engenharia de Bioprocessos da FURG (OTERO, 2011). Trabalhos anteriores demonstraram seu elevado potencial para sintetizar carotenoides (CIPOLATTI, 2012; OTERO, 2011) e, também, sua capacidade em utilizar glicerol bruto oriundo da produção de biodiesel como fonte de carbono (SPIER, 2014). Os carotenoides são corantes naturais amplamente utilizados nas indústrias alimentícia, farmacêutica, de cosméticos e ração animal, principalmente devido às suas propriedades biológicas, como atividade antioxidante, pró vitamínica A, entre outras (VALDUGA et al., 2009). O aumento da consciência dos consumidores pela saúde e alimentos funcionais vem desencadeando um aumento na demanda por carotenoides pela indústria alimentícia. Apesar da crescente procura pelos pigmentos obtidos de fontes microbianas, estes ainda possuem um elevado custo de produção do que os obtidos de fonte sintética (VENIL; ZAKARIA; AHMAD, 2013). Uma forma de reduzir estes altos custos seria o emprego de substratos alternativos e mais econômicos no cultivo destes micro-organismos, como é o caso do glicerol. Outra forma seria o pleno uso dos subprodutos resultantes do cultivo. A biomassa residual resultante do processo de extração dos lipídios poderia ser utilizada para alimentação animal, pois, contêm quantidades significativas de proteínas, carboidratos e outros nutrientes. Ou ainda, poderia ser destinada para produção de metano por digestão anaeróbia, o que tornaria o preço final mais favorável e competitivo (MENG et al., 2009). A produção biotecnológica também vem se destacando devido à comprovada atividade biológica destas biomoléculas (CIPOLATTI et al., 2015). Além disso, o cultivo de leveduras possui algumas vantagens como: rapidez de geração (leveduras têm tempo de geração entre 1-3 horas); menor área de produção (comparado à fonte vegetal); não está sujeito a variações climáticas ou mesmo pragas; melhor controle de produção e do produto, ente outras (AQUARONE et al., 2001). Neste cenário, a produção de carotenoides oriundos de fontes microbianas apresenta-se como uma alternativa importante na substituição dos pigmentos sintéticos. O gênero Rhodotorula é conhecido por sua capacidade de biossintetizar os carotenoides β-caroteno, toruleno e torularrodina, em diferentes proporções (COSTA et al., 1987; KAISER et al., 2007; OTERO, 2011). Para a produção microbiana de carotenoides em escala laboratorial tem sido estudados processos em batelada (CARDOSO et al., 2016; FREITAS et al., 2014; MACHADO; BURKERT, 2015), batelada alimentada (DIAS et al., 2015; GARCÍA CAÑEDO et al., 2016; LUNA-FLORES et al., 2010), contínuo (GHARIBZAHEDI; RAZAVI; MOUSAVI, 2014; ZHU; JIANG, 2008) e semi-contínuo (FUENTES-GRÜNEWALD et al., 2015). Estes diferentes modos de alimentação impactam no acúmulo do bioproduto de interesse ao final do processo. A diferença de cada modo de cultivo é a forma como se alimenta o biorreator com o meio. No descontínuo, ou batelada, o meio é adicionado somente no início do processo. Em batelada-alimentada, operações intermitentes de entrada do meio e saída de material fermentado são realizadas de forma repetida. Já no processo contínuo, essa alimentação é constante, assim como a saída de caldo fermentado (REGULY, 2000). A vantagem do processo em batelada alimentada é que a concentração do nutriente limitante pode ser mantida a níveis mais baixos, evitando a repressão que o mesmo pode ocasionar ao sistema. Além disso, permite um controle sobre a taxa de crescimento dos micro-organismos, uma vez que está relacionada com a taxa específica de captação de oxigênio, garantindo um maior controle sobre a demanda de oxigênio (STANBURY; WHITAKER; HALL, 1995). O objetivo deste trabalho foi estudar diferentes estratégias de batelada alimentada para a obtenção de carotenoides pela levedura Rhodotorula mucilaginosa, utilizando como fonte de carbono o glicerol bruto, coproduto da síntese de biodiesel.
Material e métodos
Neste trabalho foi utilizada a levedura Rhodotorula mucilaginosa, previamente isolada pelo grupo de trabalho e depositada na Fundação André Tosello (n°7688). A levedura foi mantida em ágar inclinado YM composto por (g/L): glicose (10), peptona (5), extrato de malte (3), extrato de levedura (3), ágar bacteriológico (20). Para o inóculo, a cultura foi raspada com água peptonada 0,1% e transferida para um Erlenmeyer contendo 180 mL de caldo YM, incubado 30 °C e 180 rpm (SPIER, 2014). Os cultivos em batelada alimentada para a produção de carotenoides foram realizados em frascos Erlenmeyer (500 mL) com volume inicial de meio de cultivo de 200 mL composto por (g/L): glicerol bruto (30), fosfato de potássio monobásico (5), fosfato dissódico (1), sulfato de magnésio heptahidratado (3), extrato de levedura (1,2), pH inicial 4,5, 25 °C, 180 rpm, 20%v/v de inóculo e concentração inicial de 107 células/mL (SPIER, 2014). Seis estratégias de batelada alimentada foram estudadas: (1) e (2): pulso de 20 mL (correspondente a 10%v/v do volume inicial do cultivo) de meio de cultivo (contendo glicerol bruto) ou glicerol bruto na fase exponencial de crescimento (48 h); (3) e (4): pulso de 20 mL de meio de cultivo ou glicerol bruto na fase estacionária (144 h); (5): dois pulsos de 20 mL de meio de cultivo (96 h e 192 h); (6): 20 mL de meio de cultivo (96 h) + 20 mL de glicerol bruto (192 h). Os pulsos de meio de cultivo e/ou glicerol bruto foram preparados em uma concentração 10 vezes maior que a do meio inicial. Durante cada cultivo, alíquotas foram retiradas para as determinações de pH, biomassa e carotenoides. Para cada condição foi calculado, também, a velocidade específica máxima de crescimento (1/h) e a produtividade em carotenoides (µg/L.h). A biomassa foi determinada por leitura da absorvância em 600 nm e conversão em massa seca (g/L) através de uma curva padrão (CHOI; PARK, 2003) e o pH por leitura em medidor de pH (AOAC, 2000). A determinação dos carotenoides totais (CT) foi realizada conforme a metodologia de Fonseca et al. (2011) modificada por Cipolatti et al. (2015). Em 0,05 g de biomassa seca (35 °C/48 h), moída, peneirada (Tyler 115) e congelada (-18 °C/48 h) foi adicionado 2 mL de dimetilsulfóxido (55 °C). A suspensão foi agitada por 1 min com intervalos de 15 min, totalizando 1 h. Após, foram adicionados 6 mL de acetona e a amostra foi centrifugada (1745×g, 10 min) para separação do solvente. O procedimento foi repetido até o branqueamento da célula. No solvente foram adicionados 10 mL de NaCl 20%m/v e 10 mL de éter de petróleo. Após agitação e separação das fases, o excesso de água foi retirado com sulfato de sódio (MICHELON et al., 2012). Os CT nos extratos foram determinados por leitura da absorvância em 448 nm (MACHADO; BURKERT, 2015) e calculados conforme Davies (1976). Todos os cultivos foram realizados em triplicata e os resultados foram tratados por análise de variância e teste de Tukey (p<0,05).
Resultado e discussão
As Figuras 1 e 2 apresentam os resultados de produção de carotenoides e a
produtividade (em termos de carotenoides) obtidos ao final de cada uma das
estratégias de batelada alimentada avaliadas no cultivo da levedura
Rhodotorula mucilaginosa, ou seja, nos valores máximos de biomassa
obtidos em cada cultivo. Também foi realizado um ensaio controle sem a
realização de pulso de nutrientes (batelada simples). A realização de pulsos
de apenas glicerol bruto, tanto na fase exponencial (48 h) como na fase
estacionária de crescimento (144 h e 192 h) da levedura em estudo ocasionou
uma diminuição na produção de biomassa e de carotenoides, comparado ao
ensaio sem pulso de nutrientes. Na produção de carotenoides esta queda foi
de 36,8% para o pulso em 48 h e 48,2% para o pulso em 144 h. Na produção de
biomassa a queda foi de 35,7% para o em 48 h e 46,4% para o pulso em 144 h.
A produtividade de carotenoides passou de 4 g/L.h para 3 g/L.h (pulso em 48
h) e 2,1 g/L.h (pulso em 144 h). Este comportamento sugere um possível
efeito inibitório causado pelo excesso de carbono no meio, que é a principal
fonte de energia da levedura.
O pulso de meio de cultivo (que contém glicerol bruto em sua composição) em
48 h, durante a fase exponencial de crescimento, também não favoreceu a
produção de carotenoides, com uma queda de 31,6%, porém, o mesmo não
influenciou o crescimento da levedura. A produção final de biomassa foi de 9
g/L no cultivo com o pulso de meio em 48 h, valor estatisticamente igual ao
obtido na batelada simples (8,4 g/L). Já o pulso de meio de cultivo durante
a fase estacionária de crescimento (144 h) ocasionou um aumento de 44,7% no
crescimento da levedura e de 27,8% na produção de carotenoides, comparado ao
ensaio em batelada simples. Sendo assim, foi necessária a adição de outros
nutrientes além da fonte de carbono (glicerol) – como extrato de levedura
(fonte de nitrogênio) e sais – para induzir uma maior produção de biomassa e
de carotenoides durante a fase estacionária (onde o micro-organismo está
desacelerando o seu metabolismo) sem causar um efeito inibitório.
O cultivo com pulso de meio em 96 h (final da fase exponencial e início da
fase estacionária) seguido de um pulso de glicerol em 192 h ocasionou um
aumento na biomassa de 29,4% e um decréscimo no conteúdo de carotenoides de
42,3%, comparado ao ensaio sem pulsos. No cultivo onde foram realizados dois
pulsos de meio, o primeiro em 96 h e o segundo em 192 h, ocorreu um aumento
de 18,8% e 48,8% na produção de carotenoides e biomassa, respectivamente.
Novamente o pulso de apenas glicerol no meio acabou inibindo a produção de
carotenoides, mesmo após a adição de outros nutrientes no pulso de 96 h.
Na literatura são encontrados poucos estudos de batelada alimentada para a
produção carotenoides. No cultivo de Luna-Flores et al. (2010) da levedura
Xanthophyllomyces dendrorhous (também conhecida como Phaffia
rhodozyma), a estratégia da batelada alimentada aumentou a produção de
carotenoides em 30,8%. No estudo de Buzzini (2001), houve um aumento de
32,5% na produção de carotenoides no cultivo em batelada alimentada da
levedura Rhodotorula glutinis. Ambos os valores foram inferiores ao
máximo obtido neste trabalho, que foi de 48,8% (2 pulsos de meio de cultivo
contendo glicerol em sua composição). A adição de 120 mg de glicerol,
juntamente com os demais nutrientes do meio, induzem uma maior produção
deste pigmento pela levedura Rhodotorula mucilaginosa, demonstrando a
potencialidade desta levedura para obtenção de carotenoides.
Diversos estudos têm sido realizados utilizando o glicerol bruto como fonte
de carbono no meio de cultivo para a produção de carotenoides. No estudo de
Kot et al. (2017) a suplementação do meio de cultura com 5%m/v de glicerol
bruto resultou em uma produção de carotenoides entre 1,5 e 3,5 mg/L pela
levedura Rhodotorula glutinis, dependendo do pH do meio utilizado. O
cultivo da levedura Phaffia rhodozyma com glicerol bruto e o efluente
água de parboilização de arroz, realizado por (SILVA et al., 2016), resultou
em uma produção máxima de carotenoides de 4,1 μg/mL.
No trabalho de Cardoso et al. (2016), a substituição do glicerol puro pelo
glicerol bruto aumentou a concentração de carotenoides em 21,4% no cultivo
da levedura Sporobolomyces ruberrimus. Lee et al. (2014) obtiveram
uma produção de carotenoides entre 18 e 28,5 mg/L utilizando 60 g/L de
glicerol no meio de cultivo para três diferentes cepas da levedura
Rhodosporidium toruloides. Já no cultivo da levedura Sporidiobolus
pararoseus com meio de cultivo contendo glicerol bruto e água de
maceração de milho, Machado e Burkert (2015) alcançaram uma produção de
carotenoides totais de 520,94 µg/L.
Com relação aos valores de velocidade específica máxima de crescimento
(µmax), os maiores resultados foram obtidos nas estratégias onde
foram realizados pulsos na fase exponencial de crescimento da levedura
(glicerol 48 h, meio de cultivo 48 h) e nas estratégias com dois pulsos
(glicerol+meio, meio+meio), sendo que estes foram estatisticamente iguais
entre si e variaram entre 0,064 e 0,067 1/h. O cultivo sem pulso de
nutrientes (controle) alcançou o menor valor de µmax, que foi de
0,047 1/h.
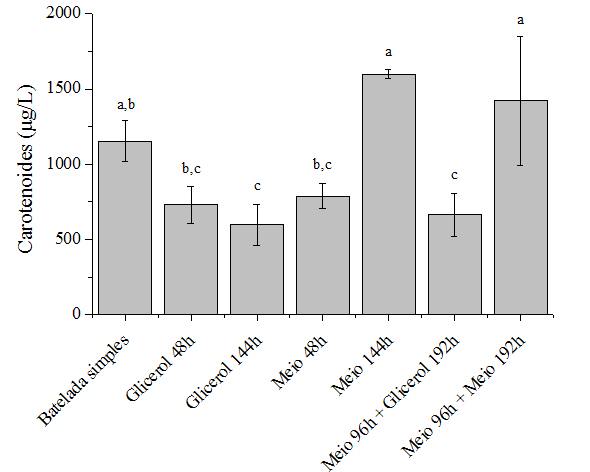
Letras diferentes indicam diferença significativa entre as médias (p<0,05).
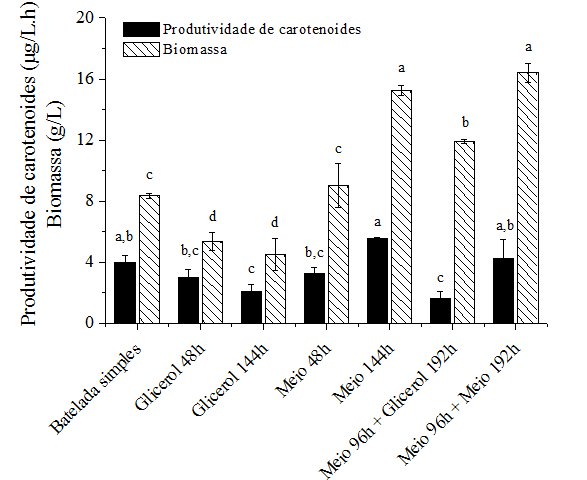
Letras diferentes indicam diferença significativa entre as médias (p<0,05).
Conclusões
A estratégia de cultivo em batelada alimentada demonstrou ser eficiente para a produção de carotenoides microbianos. Pulsos de meio de cultivo contendo glicerol bruto como fonte de carbono em 96 h e 192 h de crescimento proporcionaram um aumento na produção de carotenoides de 48,8%, alcançando uma produtividade de 4,2 µg/L.h e uma produção de biomassa de 16,4 g/L. Os pulsos contendo apenas glicerol bruto durante o cultivo causaram um efeito inibitório no crescimento da levedura e na produção de carotenoides. Os resultados obtidos neste trabalho demonstram o potencial da levedura oleaginosa Rhodotorula mucilaginosa como fonte para obtenção de carotenoides microbianos, necessitando ainda de estudos de aumento de escala.
Agradecimentos
À CAPES e ao CNPq pelo apoio financeiro e concessão de bolsas.
Referências
AOAC. Official methods of analysis of the AOAC international. 17th. Virginia: Association of Official Analytical Chemists, 2000. ISBN 9780935584240.
AQUARONE, E.; BORZANI, W.; SCHMIDELL, W.; LIMA, U. A. Biotecnologia Industrial. São Paulo: Edgar Blucher Ltda, 2001. 523 p.
BUZZINI, P. Batch and fed-batch carotenoid production by Rhodotorula glutinis Debaryomyces castellii co-cultures in corn syrup. Journal of Applied Microbiology, v. 90, n. 5, p. 843-847, May 2001.
CARDOSO, L. A. C.; JACKEL, S.; KARP, S. G.; FRAMBOISIER, X.; CHEVALOT, I.; MARC, I. Improvement of Sporobolomyces ruberrimus carotenoids production by the use of raw glycerol. Bioresource Technology, v. 200, p. 374-379, Jan 2016.
CHATZIFRAGKOU, A.; MAKRI, A.; BELKA, A.; BELLOU, S.; MAVROU, M.; MASTORIDOU, M.; MYSTRIOTI, P.; ONJARO, G.; AGGELIS, G.; PAPANIKOLAOU, S. Biotechnological conversions of biodiesel derived waste glycerol by yeast and fungal species. Energy, v. 36, n. 2, p. 1097-1108, Feb 2011.
CHOI, M. H.; PARK, Y. H. Production of yeast biomass using waste Chinese cabbage. Biomass & Bioenergy, v. 25, n. 2, p. 221-226, 2003.
CIPOLATTI, E. P. Obtenção de carotenoides microbianos com atividade antioxidante a partir de coprodutos agroindustriais. 2012. 138f. Dissertação (Mestrado em Engenharia e Ciência de Alimentos). Universidade Federal do Rio Grande, Rio Grande.
CIPOLATTI, E. P.; BULSING, B. A.; DE SÁ, C. S.; BURKERT, C. A. V.; FURLONG, E. B.; BURKERT, J. D. M. Carotenoids from Phaffia rhodozyma: antioxidant activity and stability of extracts. African Journal of Biotechnology, v. 14, n. 23, p. 1982-1988, 2015.
COSTA, I.; MARTELLI, H. L.; DASILVA, I. M.; POMEROY, D. Production of beta-carotene by a Rhodotorula-strain. Biotechnology Letters, v. 9, n. 5, p. 373-375, May 1987.
DAVIES, B. H. Chemical biochemistry plant pigments. Goodwin, T. W. (Ed). New York: Academic Press, 1976.
DIAS, C.; SOUSA, S.; CALDEIRA, J.; REIS, A.; DA SILVA, T. L. New dual-stage pH control fed-batch cultivation strategy for the improvement of lipids and carotenoids production by the red yeast Rhodosporidium toruloides NCYC 921. Bioresource Technology, v. 189, p. 309-318, Aug 2015.
FONSECA, R. A. D.; RAFAEL, R. D.; KALIL, S. J.; BURKERT, C. A. V.; BURKERT, J. F. D. Different cell disruption methods for astaxanthin recovery by Phaffia rhodozyma. African Journal of Biotechnology, v. 10, n. 7, p. 1165-1171, Feb 14 2011.
FREITAS, C.; PARREIRA, T. M.; ROSEIRO, J.; REIS, A.; DA SILVA, T. L. Selecting low-cost carbon sources for carotenoid and lipid production by the pink yeast Rhodosporidium toruloides NCYC 921 using flow cytometry. Bioresource Technology, v. 158, p. 355-359, Apr 2014.
FUENTES-GRÜNEWALD, C.; BAYLISS, C.; ZANAIN, M.; POOLEY, C.; SCOLAMACCHIA, M.; SILKINA, A. Evaluation of batch and semi-continuous culture of Porphyridium purpureum in a photobioreactor in high latitudes using Fourier Transform Infrared spectroscopy for monitoring biomass composition and metabolites production. Bioresource Technology, v. 189, p. 357-363, Aug 2015.
GARCÍA-CAÑEDO, J. C.; CRISTIANI-URBINA, E.; FLORES-ORTIZ, C. M.; PONCE-NOYOLA, T.; ESPARZA-GARCIA, F.; CANIZARES-VILLANUEVA, R. O. Batch and fed-batch culture of Scenedesmus incrassatulus: Effect over biomass, carotenoid profile and concentration, photosynthetic efficiency and non-photochemical quenching. Algal Research-Biomass Biofuels and Bioproducts, v. 13, p. 41-52, Jan 2016.
GHARIBZAHEDI, S. M. T.; RAZAVI, S. H.; MOUSAVI, M. Carotenoid production from hydrolyzed molasses by Dietzia natronolimnaea HS-1 using batch, fed-batch and continuous culture. Annals of Microbiology, v. 64, n. 3, p. 945-953, Sep 2014.
KAISER, P.; SURMANN, P.; VALLENTIN, G.; FUHRMANN, H. A small-scale method for quantitation of carotenoids in bacteria and yeasts. Journal of Microbiological Methods, v. 70, n. 1, p. 142-149, Jul 2007.
KNOTHE, G.; GERPEN, J. V.; KRAHL, J.; RAMOS, L. P. Manual de biodiesel. São Paulo: Edgar Blucher, 2006.
KOT, A. M.; BLAZEJAK, S.; KURCZ, A.; BRYS, J.; GIENTKA, I.; BZDUCHA-WROBEL, A.; MALISZEWSKA, M.; RECZEK, L. Effect of initial pH of medium with potato wastewater and glycerol on protein, lipid and carotenoid biosynthesis by Rhodotorula glutinis. Electronic Journal of Biotechnology, v. 27, p. 25-31, May 2017.
LEE, J. J. L.; CHEN, L. W.; SHI, J. H.; TRZCINSKI, A.; CHEN, W. N. Metabolomic profiling of Rhodosporidium toruloides grown on glycerol for carotenoid production during different growth phases. Journal of Agricultural and Food Chemistry, v. 62, n. 41, p. 10203-10209, Oct 15 2014.
LI, Q.; DU, W.; LIU, D. Perspectives of microbial oils for biodiesel production. Applied Microbiology and Biotechnology, v. 80, n. 5, p. 749-756, 2008.
LORA, E. E. S.; VENTURINI, O. J. Biocombustíveis. 1ª ed. Rio de Janeiro: Interciência, 2012.
LUNA-FLORES, C. H.; RAMIREZ-CORDOVA, J. J.; PELAYO-ORTIZ, C.; FEMAT, R.; HERRERA-LOPEZ, E. J. Batch and fed-batch modeling of carotenoids production by Xanthophyllomyces dendrorhous using Yucca fillifera date juice as substrate. Biochemical Engineering Journal, v. 53, n. 1, p. 131-136, Dec 15 2010.
MACHADO, W. R. C.; BURKERT, J. F. D. M. Optimization of agroindustrial medium for the production of carotenoids by wild yeast Sporidiobolus pararoseus. African Journal of Microbiology Research, v. 9, n. 4, p. 209-219, 2015.
MENG, X.; YANG, J.; XU, X.; ZHANG, L.; NIE, Q.; XIAN, M. Biodiesel production from oleaginous microorganisms. Renewable Energy, v. 34, n. 1, p. 1-5, 2009.
MICHELON, M.; DE BORBA, T. D.; RAFAEL, R. D.; BURKERT, C. A. V.; BURKERT, J. F. D. Extraction of carotenoids from Phaffia rhodozyma: A Comparison between different techniques of cell disruption. Food Science and Biotechnology, v. 21, n. 1, p. 1-8, Feb 2012.
OTERO, D. M. Bioprospecção de leveduras silvestres produtoras de carotenoides. 2011. 107 f. Dissertação (Mestrado em Engenharia e Ciência de Alimentos). Universidade Federal do Rio Grande, Rio Grande.
PAN, L.-X.; YANG, D.-F.; SHAO, L.; LI, W.; CHEN, G.-G.; LIANG, Z.-Q. Isolation of the oleaginous yeasts from the soil and studies of their lipid-producing capacities. Food Technology and Biotechnology, v. 47, n. 2, p. 215-220, 2009.
REGULY, J. C. Biotecnologia dos processos fermentativos. Pelotas: Ed. Universitária-UFPel, 2000.
SILVA, C. M.; DE BORBA, T. D.; KALIL, S. J.; BURKERT, J. F. D. Raw glycerol and parboiled rice effluent for carotenoid production: Effect of the composition of culture medium and initial ph. Food Technology and Biotechnology, v. 54, n. 4, p. 489-496, Oct-Dec 2016.
SPIER, F. Produção de lipídios microbianos a partir de glicerol bruto gerado na síntese de biodiesel. 2014. 190 f. Tese (Doutorado em Engenharia e Ciência de Alimentos). Universidade Federal do Rio Grande, Rio Grande.
STANBURY, P. F.; WHITAKER, A.; HALL, S. J. Principles of fermentation technology. 2 ed. Oxford: Butterworth-Heinemann, 1995.
VALDUGA, E.; TATSCH, P. O.; TIGGEMANN, L.; TREICHEL, H.; TONIAZZO, G.; ZENI, J.; DI LUCCIO, M.; FURIGO, A. Produção de carotenoides: microrganismos como fonte de pigmentos naturais. Química Nova, v. 32, n. 9, p. 2429-2436, 2009.
VENIL, C. K.; ZAKARIA, Z. A.; AHMAD, W. A. Bacterial pigments and their applications. Process Biochemistry, v. 48, n. 7, p. 1065-1079, Jul 2013.
ZHU, Y. H.; JIANG, J. G. Continuous cultivation of Dunaliella salina in photobioreactor for the production of beta-carotene. European Food Research and Technology, v. 227, n. 3, p. 953-959, Jul 2008.
































