Produção de enzimas xilanolíticas e xilo-oligossacarídeos pela levedura Aureobasidium pullulans
ISBN 978-85-85905-21-7
Área
Alimentos
Autores
Gautério, G.V. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Cardoso, M.V. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; da Silva, L.G.G. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Kalil, S.J. (UNIVERSIDADE FEDERAL DO RIO GRANDE)
Resumo
O presente trabalho investigou a produção simultânea de enzimas xilanolíticas e xilo-oligossacarídeos (XOS) por diferentes cepas da levedura Aureobasidium pullulans (CCT 7521, CCT 4154 e CCT 1261). O meio de cultivo teve a xilana de madeira de faia como principal substrato. A produção de enzimas xilanolíticas e XOS, além do pH e biomassa, foi acompanhada por 96 h de cultivo. Dentre as cepas estudadas, a CCT 1261 apresentou maior produção de endo-β-1,4-xilanase (74,94 ± 0,76 U/mL), biomassa (4,11 ± 0,15 g/L), μmax (0,18 ± < 0,01 1/h) e produtividade enzimática máxima (1,25 ± 0,01 U/mL.h), e menor relação β-xilosidase/endo- β-1,4-xilanase (0,002). A produção total de XOS foi de 1,57 ± 0,06 mg/mL em 12 h de cultivo, sendo composta majoritariamente por xilobiose e xilotriose.
Palavras chaves
cultivo submerso; endo-β-1,4-xilanase; xilo-oligossacarídeos
Introdução
A biomassa lignocelulósica pode ser considerada a matéria-prima renovável mais abundante e amplamente distribuída na natureza, compreendendo majoritariamente os materiais oriundos da agroindústria, resíduos urbanos e florestais (JÖNSSON; MARTÍN, 2016). Existem diversos substratos lignocelulósicos potencialmente utilizáveis na obtenção de produtos de alto valor agregado como biocombustíveis, biofilmes, enzimas, açúcares, entre outros (CHAPLA;PANDIT; SHAH, 2012). Materiais como palha, bagaço de cana, sabugo de milho, torta de malte, amêndoas, madeira, casca e farelo de alimentos, possuem a fração hemicelulósica constituída principalmente por xilana (GULLÓN et al., 2010), heteropolissacarídeo formado por subunidades de xilose unidas por ligações β-1,4 e cadeias laterais de arabinose, galactose, manose, glicose e ácidos (GOWDHAMAN; PONNUSAMI, 2015). Devido à complexidade estrutural da xilana, a transformação desses materiais em produtos de aplicação industrial, tais como xilose, xilitol e xilo- oligossacarídeos (XOS), requer que um sistema múltiplo de enzimas com distintas especificidades e modos de ação atue na quebra da cadeia desse polissacarídeo (GOWDHAMAN; PONNUSAMI, 2015). Dentre as enzimas que compõem o complexo xilanolítico, duas merecem destaque: a endo-β-1,4-xilanase (EC 3.2.1.8), a qual está envolvida na quebra das ligações glicosídicas β-1,4 e liberações de pequenas frações de açúcares (XOS); e a β-xilosidase (EC 3.2.1.37), que atua na extremidade não redutora da xilobiose ou de outros XOS, resultando em xilose (SHENG et al., 2014). As endo-β-1,4-xilanases são aplicadas principalmente na indústria de papel e celulose (BORUAH et al., 2016), de alimentos (LI et al., 2013; SHAHRESTANI et al., 2016; VERJANS et al., 2010) e de rações (VANDEPLAS et al., 2010), de modo a facilitar processos industriais e melhorar características tecnológicas ou nutricionais. Dentre as aplicações alimentícias, as endo-β-1,4-xilanases têm sido estudadas como biocatalisadores na produção de XOS a partir de materiais lignocelulósicos (CHAPLA; PANDIT; SHAH, 2012; FARYAR et al., 2015; REDDY; KRISHNAN, 2016), uma vez que a reações envolvidas contam com a especificidade enzimática, ocorrem em condições brandas de temperatura e não formação de compostos tóxicos (CHAPLA; PANDIT; SHAH, 2012; YANG et al., 2011). Os XOS são oligômeros não digeríveis contendo entre duas a dez unidades de xilose unidas por ligações β-1,4 (MONIZ et al., 2014). Devido à sua atoxicidade, certificação GRAS (Generally Recognized as Safe), propriedades bioativas e funcionais, os XOS podem ser utilizados como adoçantes de baixa caloria e na formulação de alimentos e bebidas prebióticas (FOOD AND DRUG ADMINISTRATION, 2013). Quando aplicados para fins de produção de XOS, complexos enzimáticos com alta atividade de endo-β-1,4- xilanase e baixa atividade de β-xilosidase são desejados, pois atenuam a produção de xilose e aumentam o rendimento de XOS (VÁZQUEZ et al., 2002). Organismos como fungos filamentosos (AHMED et al., 2016) e bactérias (IRFAN et al., 2016) são capazes de secretar endo-β-1,4-xilanases em grandes quantidades. No entanto, algumas espécies secretam concomitantemente celulases (ANG et al., 2013; DOS REIS et al., 2013) e β-xilosidases (TERRASAN et al., 2013), esta última responsável pelo acúmulo de xilose e possível inibição da atividade de endo-β-1,4-xilanases (VÁZQUEZ et al., 2002). Por outro lado, o uso leveduras na produção de endo-β-1,4-xilanases tem se mostrado promissor para obtenção de extratos enzimáticos mais homogêneos, uma vez que essas podem produzir endo-β-1,4-xilanases livres de celulases e β-xilosidases com menor atividade enzimática (OTERO et al., 2015), levando à uma menor quantidade de xilose residual no meio extracelular. Estudos têm mostrado a levedura Aureobasidum pullulans como produtora de endo-β-1,4-xilanases com alta atividade enzimática (CHRISTOV et al., 1997; YEGIN, 2017), mesmo quando utilizado substratos lignocelulósicos agroindustriais no meio de cultivo (YEGIN et al., 2016). Adicionalmente, existem poucos relatos na literatura que abordam a produção simultânea de XOS e enzimas xilanolíticas por espécies microbianas (MENEZES; ROSSI; AYUB, 2017; PUCHART; BIELY, 2008). Nesse sentido, o presente trabalho teve como objetivo investigar a produção simultânea de enzimas xilanolíticas e XOS pela levedura Aureobasidum pullulans em cultivo submerso.
Material e métodos
Três cepas da levedura Aureobasidium pullulans (CCT 7521, CCT 4154 e CCT 1261), adquiridas da Fundação André Tosello, foram avaliadas quanto à produção simultânea de enzimas xilanolíticas e XOS. As cepas da levedura foram reativadas através do repique para ágar batata dextrose inclinado (WEI et al., 2017) a partir das cepas estoques, sendo posteriormente mantidas a 24°C por 72 h (YEGIN et al., 2016). O preparo do pré-inóculo consistiu na transferência da massa celular contida na superfície do ágar para tubos contendo 5 mL de meio estéril composto por (g/L): xilose (10), base nitrogenada de levedura (6,7), asparagina (2) e KH2PO4 (5) em pH 5,0 (CHRISTOV et al., 1997). Os tubos foram incubados a 28°C durante 24 h. Para o crescimento do inóculo, o volume correspondente ao pré- inóculo (5 mL) foi vertido para Erlenmeyers contendo 45 mL do mesmo meio estéril, os quais foram mantidos a 28°C e 150 rpm (agitação orbital) durante 24 h. Os cultivos foram conduzidos utilizando 150 mL meio estéril contido em frascos Erlenmeyers aletados composto por (g/L): xilana de madeira de faia (10), extrato de levedura (1), (NH4)SO4 (2,5) e KH2PO4 (5) em pH 5,0 (YEGIN, 2017). Os frascos contendo o meio estéril foram inoculados com 2% (v/v) de inóculo com densidade ótica (DO) a 620 nm padronizada em 0,8 (SUGUMARAN et al., 2013), e mantidos a 28°C, 150 rpm (agitação orbital) por 96 h. Amostras do cultivo foram coletadas a cada 12 h e centrifugadas a 21.380 × g e 4°C durante 5 min. O sobrenadante livre de células foi analisado quanto à atividade de endo-β-1,4-xilanase (BAILEY; BIELY; POUTANEN, 1992) e quantificação de açúcares redutores (MILLER, 1959), atividade de β-xilosidase (TAN; MAYERS; SADDLER, 1987) e pH (AOAC, 2000). Todos os cultivos foram realizados em triplicata. Após filtragem em membrana de fluoreto de polivinilideno (0,22 µm de poros), o sobrenadante também foi analisado quanto à presença de XOS por cromatografia líquida de alta eficiência (CLAE), utilizando coluna Aminex HPX-42A (Bio-Rad, Califórnia, Estados Unidos) para a análise de carboidratos e padrões analíticos de xilose e XOS com diferentes graus de polimerização (GP) (GUIDO et al., 2017). O precipitado da centrifugação foi analisado quanto à concentração de biomassa a 620 nm, correlacionando as leituras com as respectivas curvas de calibração de biomassa seca de cada cepa (GALIOTOU-PANAYOTOU; KALANTZI; AGGELIS, 1998). Os parâmetros cinéticos como velocidade máxima específica de crescimento (μmax) e a produtividade enzimática máxima (P), foram calculados a partir da curva de crescimento de cada cepa em estudo (HISS, 2001).
Resultado e discussão
A Figura 1a apresenta o acompanhamento da produção de endo-β-1,4-xilanase
pelas três cepas de Aureobasidium pullulans em estudo. A cepa CCT
1261 (AP3) apresentou a maior atividade de endo-β-1,4-xilanase (74,94 ± 0,76
U/mL) em comparação às demais cepas estudadas, sendo a produção máxima
alcançada em 60 h. As cepas CCT 7521 (AP1) e CCT 4154 (AP2) apresentaram
atividade máxima de endo-β-1,4-xilanase de 2,60 ± 0,06 U/mL e 3,37
± 0,21 U/mL, respectivamente, em 36 h de cultivo. Para o mesmo tempo de
cultivo (36 h), a cepa AP3 já havia produzido endo-β-1,4-xilanase com
atividade de 45,33 ± 1,99 U/mL. A produção de endo-β-1,4-xilanase pode
variar conforme a cepa utilizada, segundo o estudo de Yegin (2017), o qual
avaliou a produção de endo-β-1,4-xilanase por três cepas de Aureobasidium
pullulans (DMS 2404, NRRL Y-2311-1 e NRRL Y12, 974). A cepa Y-2311-1 se
mostrou a maior produtora da enzima, alcançando a atividade máxima de 252,78
U/mL após 96 h de cultivo em meio otimizado contendo xilana. Valores de
atividade de endo-β-1,4-xilanase semelhantes aos observados para as cepas
AP1 e AP2 foram observados por Nars et al. (2013), onde o valor máximo de
2,73 U/mL foi alcançado para a levedura Aureobasidium pullulans
SN090. Conforme mostra a Figura 1b, todas as cepas em estudo produziram β-
xilosidase, cuja atividade aumentou no decorrer do cultivo. Embora as três
cepas tenham apresentado baixos níveis de β-xilosidase após 96 h, a relação
β-xilosidase/endo-β-1,4-xilanase foi menor para a cepa AP3 (0,002) em
comparação às cepas AP1 (0,07) e AP2 (0,119). O uso de extratos enzimáticos
com baixa relação entre β-xilosidase/endo-β-1,4-xilanase são preferíveis na
produção de XOS, pois atenuam a produção de xilose que pode inibir a
atividade de endo-β-1,4-xilanase (VÁZQUEZ et al., 2002) e originar mistura
de XOS mais impuras e com menor atividade prebiótica (ESCARNOT; AGUEDO,
PAQUOT, 2012). Com base nos níveis de endo-β-1,4-xilanase e β-xilosidase, a
cepa AP3 se mostrou a mais indicada para posterior produção de XOS por
hidrólise enzimática. Em relação ao pH (Figura 1c), as três cepas
apresentaram decréscimo em seu valor nas 24 h de cultivo: 3,75 ± 0,12 para
AP1, 3,75 ± 0,03 para AP2 e 3,76 ± 0,03 para AP3. Para as cepas AP1 e AP2,
os valores de pH aumentaram após 24 h, alcançando os valores máximos de 5,69
± 0,06 e 5,62 ± 0,03, respectivamente, às 96 h de cultivo. Esse
comportamento foi semelhante ao observado por Yegin et al. (2016) durante a
produção de endo-β-1,4-xilanase por Aureobasidium pullulans Y-2311-1,
onde houve decréscimo no pH nas primeiras 24 h, bem como o aumento dos seus
valores ao longo do cultivo. Por outro lado, a cepa AP3 apresentou menor
variação do pH após 24 h, se mantendo entre 3,52 ± 0,03 (36 h) e 3,88 ± 0,08
(84 h), e alcançando o valor máximo de 4,10 ± 0,15 ao término do cultivo (96
h). Quanto à produção de biomassa (Figura 1d), a cepa AP3 foi a que mais se
destacou em termos de crescimento celular, uma vez que alcançou o valor
máximo de 4,11 ± 0,15 g/L às 72 h de cultivo. Já para as cepas AP1 e AP2, a
concentração de biomassa máxima foi de 3,37 ± 0,17 g/L (72 h) e 2,99 ± 0,12
g/L (48 h), respectivamente. A velocidade específica de crescimento máxima
(μmax) apresentou valor de 0,12 ± 0,01 1/h, 0,16 ± < 0,01 1/h e 0,18 ± <
0,01 1/h para as cepas AP1, AP2 e AP3, nesta ordem. A produtividade (P)
máxima em termos de endo-β-1,4-xilanase para as cepas AP1, AP2 e AP3 foi
de 0,07 ± < 0,01 U/mL.h, 0,09 ± < 0,01 U/mL.h e 1,25 ± 0,01 U/mL.h,
respectivamente. A produção de XOS para as cepas AP2 e AP3 foi constatada
nas primeiras 12 h de cultivo e em baixas concentrações, não sendo detectada
a presença de xilopentose (Tabela 1). Para a cepa AP3, a presença de
xilotriose (0,06 mg/mL) e xilose (0,34 mg/mL) foi constatada também em 24 h
de cultivo. Já para a cepa AP1, foi observada a presença de xilose
(1,65 mg/mL), xilobiose (0,13 mg/mL) e xilotriose (0,07 mg/mL) após 24 h de
cultivo, bem como xilose após 36 h (0,57 mg/mL), 48 h (0,08 mg/mL) e 72 h
(0,07 mg/mL). Devido à ausência de XOS nas demais horas de cultivo, é
possível supor que a levedura utiliza os oligossacarídeos produzidos como
fonte de nutrientes para o seu crescimento. Menezes, Rossi e Ayub (2017) ao
avaliar a produção de XOS e endo-β-1,4-xilanase por Aspergillus
brasiliensis BLf1 em cultivo em estado sólido, observaram que a produção
de oligossacarídeos ocorreu nas primeiras 48 h de cultivo, não coincidindo
com o pico de produção máxima da enzima. Os maiores níveis de XOS para as
três cepas foram em termos de xilobiose e xilotriose, conforme mostra a
Tabela 1. Segundo Van Craeyveld et al. (2008), o efeito prebiótico dos XOS
depende da sua fermentação por bactérias do cólon, fato este relacionado com
a sua estrutura e o grau de polimerização (GP). XOS com GP igual ou inferior
a cinco proporcionam o crescimento de bifidobactérias importantes para a
manutenção da microflora intestinal saudável, enquanto que XOS com GP
maiores não estimulam o desenvolvimento bacteriano. Assim, para aplicação em
alimentos com alegação prebiótica, XOS com GP entre 2 a 4 são desejáveis.
Com base nos resultados acima apresentados, a cepa CCT 1261 (AP3) se mostrou
a mais eficiente para a produção de endo-β-1,4-xilanase e com baixa produção
de β-xilosidase. Apesar dos baixos níveis de XOS produzidos em cultivo
submerso, cabe ressaltar que há necessidade de otimizar as condições de
cultivo da levedura, visando à maior produção concomitante de endo-β-1,4-
xilanase e XOS.
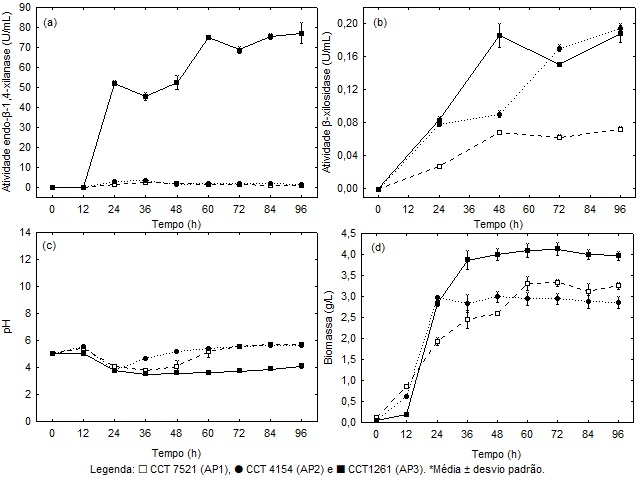
Figura 1 - Acompanhamento da atividade de (a) endo-β-1,4-xilanases e (b) β-xilosidase, (c) pH e (d) biomassa no cultivo de Aureobasidium pullulans
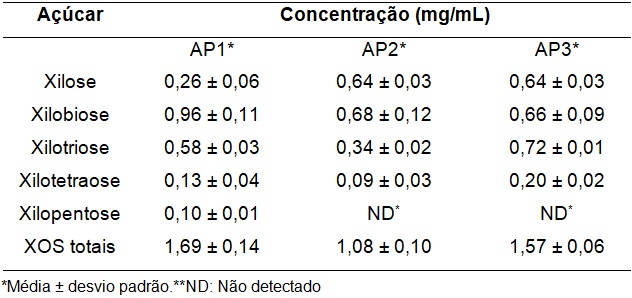
Tabela 1 - Xilo-oligossacarídeos (XOS) produzidos por Aureobasidium pullulans CCT 7521 (AP1), CCT 4154 (AP2) e CCT 1261 (AP3) em 12 h de cultivo
Conclusões
A produção simultânea de enzimas xilanolíticas e xilo-oligossacarídeos (XOS) em cultivo submerso por três cepas da levedura Aureobasidium pullulans foi investigada. A cepa CCT 1261 (AP3) se destacou na produção de endo-β-1,4- xilanase (74,94 ± 0,76 U/mL), apresentando atividade enzimática máxima em 60 h de cultivo, e menor relação β-xilosidase/endo-β-1,4-xilanase (0,002). A cepa também se destacou quanto ao crescimento celular (4,11 ± 0,15 g/L), velocidade específica de crescimento máxima (0,18 ± < 0,01 1/h) e produtividade máxima em termos de endo-β-1,4-xilanase (1,25 ± 0,01 U/mL.h). A produção de XOS pela cepa AP3 foi verificada nas primeiras 12 h de cultivo, alcançando a concentração total de 1,57 ± 0,06 mg/mL, e sendo composto majoritariamente por xilobiose e xilotriose.
Agradecimentos
A Capes, CNPq e FAPERGS.
Referências
AHMED, S.A.; SALEH, S.A.A.; MOSTAFA, F.A.; ABD EL ATY, A.A.; AMMAR, H.A.M. Characterization and valuable applications of xylanase from endophytic fungus Aspergillus terreus KP900973 isolated from Corchorus olitorius. Biocatalysis and Agricultural Biotechnology, v. 7, p. 134–144, 2016.
ANG, S.K.; SHAZA, E.M.; ADIBAH, Y.; SURAINI, A.A.; MADIHAH, M.S. Production of cellulases and xylanase by Aspergillus fumigatus SK1using untreated oil palm trunk through solid state fermentation. Process Biochemistry, v. 48, p. 1293–1302, 2013.
ASSOCIATION OF OFFICIAL ANALYTICAL CHEMISTS (AOAC). Official Methods of Analysis of International. 17 th, 2000. 1 CD-ROM.
BAILEY, M. J.; BIELY, P.; POUTANEN, K. Interlaboratory testing of methods for assay of xylanase activity. Journal of Biotechnology, v. 23, n. 3, p. 257–270, 1992.
BORUAH, P.; DOWARAH, P.; HAZARIKA, R.; YADAV, A.; BARKAKATI, P.; GOSWAMI, T. Xylanase from Penicillium meleagrinum var. viridiflavum e a potential source for bamboo pulp bleaching. Journal of Cleaner Production, v. 116, p. 259–267, 2016.
CHAPLA, D.; PANDIT, P.; SHAH, A. Production of xylooligosaccharides from corncob xylan by fungal xylanase and their utilization by probiotics. Bioresource Technology, v. 115, p. 215–221, 2012.
CHRISTOV, L.P.; MYBURGH, J.; TONDER, A.; PRIOR, B.A. Hydrolysis of extracted and fibre-bound xylan with Aureobasidium pullulans enzymes. Journal of Biotechnology, v. 55, p. 21–29, 1997.
DOS REIS, L.; FONTANA, R.C.; DELABONA, P.S.; LIMA, D.J.S.; CAMASSOLA, M.; PRADELLA, J.G.C.; DILLON, A.J.P. Increased production of cellulases and xylanases by Penicillium echinulatum S1M29 in batch and fed-batch culture. Bioresource Technology, v. 146, p. 597–603, 2013.
ESCARNOT, E.; AGUEDO, M.; PAQUOT, M. Enzymatic hydrolysis of arabinoxylans from spelt bran and hull. Journal of Cereal Science, v. 55, p. 243-253, 2012.
FARYAR, R.; LINARES-PASTÉN, J.A.; IMMERZEEL, P.; MAMO, G.; ANDERSSON, M.; STALBRAND, H.; MATTIASSON, B.; KARLSSON, E.N. Production of prebiotic xylooligosaccharides from alkaline extracted wheat straw using the K80R-variant of a thermostable alkali-tolerant xylanase. Food and Bioproducts Processing, v. 93, p. 1–10, 2015.
FOOD AND DRUG ADMINISTRATION OF THE UNITED STATES OF AMERICA (FDA). GRAS Notice GRN No. 458 (Xylooligosaccharides).Disponível em: <https://www.fda.gov/downloads/Food/IngredientsPackagingLabeling/GRAS/NoticeInventory/ucm349361.pdf>. Acesso em: 10 de julho de 2017.
GALIOTOU-PANAYOTOU, M.; KALANTZI, O.; AGGELIS, G. Modelling of simultaneous production of polygalacturonase and exopolysaccharide by Aureobasidium pullulans ATHUM 2915. Antonie van Leeuwenhoek, v.73, p. 155–162, 1998.
GOWDHAMAN, D.; PONNUSAMI, V. Production and optimization of xylooligosaccharides from corncob by Bacillus aerophilus KGJ2 xylanase and its antioxidant potential. International Journal of Biological Macromolecules, v. 79, p. 595–600, 2015.
GUIDO, E.S. Produção de xilo-oligossacarídeos por hidrólise enzimática de xilanas. 2016.120 f. Tese (Doutorado em Engenharia e Ciência de Alimentos) – Universidade Federal do Rio Grande, Rio Grande, 2016.
GULLÓN, P; GONZALES-MUNOZ, M.J.; GOOL, M.P.; SCHOLS, H.A.; HIRSCH, J.; EBRINGEROVA, A.; PARAJO, J. Production, refining, structural characterization and fermentability of rice husk xylooligosaccharides. Journal of Agricultural and Food Chemistry, v. 58, n. 6, p. 3632–3641, 2010.
HISS, H. Cinética de processos fermentativos. In: SCHIMIDELL, W.; LIMA, U.A.; AQUARONE, E.; BORZANI, W. Biotecnologia Industrial: Engenharia Bioquímica. São Paulo: Ed. Edgar Blücher Ltda, 2001, Cap 6, p.93-121
IRFAN, M.; ASGHAR, U.; NADEEM, M.; NELOFER, R.; SYED, Q. Optimization of process parameters for xylanase production by Bacillus sp. in submerged fermentation. Journal of Radiation Research and Applied Sciences, v. 9, n. 2, p. 139–147, 2016.
JÖNSSON, L. J.; MARTÍN, C. Pretreatment of lignocellulose: formation of inhibitory by-products and strategies for minimizing their effects. Bioresource Technology, v.199, p. 103–112, 2016.
LI, J.; HOU, G.G.; CHEN, Z.; GEHRING, K. Effects of endoxylanases, vital wheat gluten, and gum arabic on the rheological properties, water mobility, and baking quality of whole-wheat saltine cracker dough. Journal of Cereal Science, v. 58, p. 437–445, 2013.
MENEZES, B.S.; ROSSI, D M.; AYUB, M. A. Z. Screening of filamentous fungi to produce xylanase and xylooligosaccharides in submerged and solid-state cultivations on rice husk, soybean hull, and spent malt as substrates. World Journal of Microbiology & Biotechnology, v. 33, p. 33–58, 2017.
MILLER, G. L. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analitycal Chemistry, v. 31, n. 3, p. 426–428, 1959.
NARS, S.; SOUDI, M.R.; SALMANIAN, A.H.; GHADAM, P. Partial optimization of endo-1, 4-β-xylanase production by Aureobasidium pullulans using agro-industrial residues. Iranian Journal of Basic Medical Sciences, v. 16, n. 12, p. 1245–1253, 2013.
OTERO, D. M.; CADAVAL, C.L.; TEIXEIRA, L.M.; ROSA, C.A.; SANZO, A.V.L.; KALIL, S.J. Screening of yeasts capable of producing cellulase-free xylanase. African Journal of Biotechnology, v. 14, n. 23, p. 1961–1969, 2015.
PUCHART, V.; BIELY, P. Simultaneous production of endo-1,4-xylanase and branched xylooligosaccharides by Thermomyces lanuginosus. Bioresource Technology, v. 99, n. 13, p. 5341–5351, 2008.
REDDY, S. S.; KRISHNAN, C. Production of high-pure xylooligosaccharides from sugarcane bagasse using crude β-xylosidase-free xylanase of Bacillus subtilis KCX006 and their bifidogenic function. LWT - Food Science and Technology, v. 65, p. 237–245, 2016.
SHAHRESTANIA, H.; TAHERI-KAFRANIB, A.; SOOZANIPOURB, A.; TAVAKOLIA, O. Enzymatic clarification of fruit juices using xylanase immobilized on 1,3,5-triazine-functionalized silica-encapsulated magnetic nanoparticles. Biochemical Engineering Journal, v. 109, p. 51–58, 2016.
SHENG, P.; XU, J.; SACCONE, G.; LI, K; ZHANG, H. Discovery and characterization of endo-xylanase and β-xylosidase from a highly xylanolytic bacterium in the hindgut of Holotrichia parallela larvae. Journal of Molecular Catalysis B: Enzymatic, v. 105, p. 33–40, 2014.
SUGUMARAN, K.R.; ,GOWTHAMI, E.; SWATHI, B.; ELAKKIYA, S.; SRIVASTAVA, S.N.; RAVIKUMAR, R. GOWDHAMAN, D.; PONNUSAMI, V. Production of pullulan by Aureobasidium pullulans from Asian palm kernel: A novel substrate. Carbohydrate Polymers, v. 92, p. 697– 703, 2013.
TAN, L.; MAYERS, P.; SADDLER, J. Purification and characterization of thermostable xylanase from a thermophilic fungus Thermoascus aurantiacus. Canadian Journal of Microbiology, v. 33, p. 689–692, 1987.
TERRASAN, C.; TEMER, B.; SARTO, C.; SILVA JÚNIOR, F.; CARMONA, E. Xylanase and β-xylosidase from Penicillium janczewskii: production, physico-chemical properties, and application of the crude extract to pulp biobleaching. BioResources, v. 8, n. 1, p. 1292–1305, 2013.
VANDEPLAS, S.; DAUPHIN, R.D.; THORNART, P.; THÉWIS, A.; BECKERS, Y. Effect of the bacterial or fungal origin of exogenous xylanases supplemented to a wheat-based diet on performance of broiler chickens and nutrient digestibility of the diet. Canadian Journal of Animal Science, v. 90, n. 2, p. 221–228, 2010.
VAN CRAEYVELD, V.; SWENNEN, K.; DOMEZ, E.; VAN DE WIELE, T.; MARZORATI, M.; VERSTRAETE, W.; DELAEDT, Y.; ONAGBESAN, O.; DECUYPERE, E.; BUYSE, J.; DE KETELAERE, B.; BROEKAERT, W.F.; DELCOUR, J.A.; COURTIN, C.M. Structurally different wheat-derived arabinoxylooligosaccharides have different prebiotic and fermentation properties in rats. The Journal of Nutrition, v. 138, n. 12, p. 2348-2355, 2008.
VÁZQUEZ, M.J.; ALONSO, J.L.; DOMÍNGUEZ, H.; PARAJÓ, J.C. Enzymatic processing of crude xylooligomer solutions obtained by autohydrolysis of eucalyptus wood. Food Biotechnology, v. 16, n. 2, p. 91-105, 2002.
VERJANS, P.; DORNEZ, E.; DELCOUR, J.A.; COURTIN, C.M. Selectivity for water-unextractable arabinoxylan and inhibition sensitivity govern the strong bread improving potential of an acidophilic GH11 Aureobasidium pullulans xilanase. Food Chemistry, v. 123, n. 2, 331–337, 2010.
WEI, P.; CHENG, C.; LIN, M.; ZHOU, Y.; YANG, S. Production of poly(malic acid) from sugarcane juice in fermentation by Aureobasidium pullulans: Kinetics and process economics. Bioresource Technology, v. 224, p. 581–589, 2017.
YANG, H.; WANG, K.; SONG, X.; XU, F. Production of xylooligosaccharides by xylanase from Pichia stipitis based on xylan preparation from triploid Populas tomentosa. Bioresource Technology, v. 102, n. 14, p. 7171–7176, 2011.
YEGIN, S. Aureobasidium pullulans ile ksilanaz üretimine etki eden biyoproses parametrelerin belirlenmesi. Gida, v. 42, n. 1, p. 67–75, 2017.
YEGIN, S.; BUYKKILECI, A.O.; SARGIN, A.; GOKSUNGUR, Y. Exploitation of agricultural wastes and by-products for production of Aureobasidium pullulans Y-2311-1 xylanase: screening, bioprocess optimization and scale up. Waste and Biomass Valorization, v. 8, n. 3, p. 999–1010, 2016.
































