ISBN 978-85-85905-19-4
Área
Bioquímica e Biotecnologia
Autores
Araújo, J.A. (UFPA) ; Ferreira, A.S.C. (UFPA) ; Alves, Y.F.M. (UFPA) ; Silva, C.L. (UFPA) ; Ferreira, N.R. (UFPA) ; Lopes, A.S. (UFPA)
Resumo
Objetivou-se isolar os fungos filamentosos presentes no processo fermentativo do cacau do Município de Tucumã, PA e avaliar o potencial enzimático de cada isolado na atividade celulolítica. As sementes de cacau foram coletadas nos tempos 0, 24, 48, 72, 96, 120, 144 e 168 horas de fermentação. O isolamento foi realizado conforme a metodologia descrita pelo of Methods for the Microbiological Examination of Foods. O Índice Enzimático - IE foi obtido mediante a relação entre o diâmetro médio do halo de degradação e o diâmetro médio do micélio do fungo. A maioria dos fungos filamentosos isolados da fermentação do cacau em Tucumã, PA apresentam atividade extracelular na produção de celulases, no entanto, somente quatro dos isolados foram considerados potenciais produtores de celulase.
Palavras chaves
Celulase; Indústria; Micro-organismo
Introdução
A fermentação é uma das etapas do processamento do cacau (SANTOS, 2010). Nesta etapa, a polpa envoltória das sementes é degradada pela ação contínua de micro-organismos (LOPEZ, 1986), dentre esses, os fungos filamentosos merecem destaque, pois crescem abundantemente em habitats onde há a presença de açúcares, como é o caso da polpa do cacau (MADIGAN; MARTINKO; PARKER, 2004). Muitas espécies de fungos filamentosos possuem a capacidade de produzir enzimas extracelulares (ROSA; CAMPOS; BARONI, 2002). Estas são mais utilizadas que as derivadas de plantas e animais, pois apresentam características desejáveis como maior rendimento, uma melhor estabilidade e uma elevada atividade catalítica (COELHO e NASCIMENTO, 2008; RAO et al., 1998). Fungos filamentosos são potenciais produtores de enzimas extracelulares, esses representam a mais ampla classe de enzimas aplicadas no ramo da biotecnologia (MORENO et al., 2013). Estas enzimas são úteis em aplicações industriais, tais como processamento de alimentos, cervejaria, biocombustíveis, biorremediação etc. Para essas aplicações, torna-se necessário a exploração de novas fontes úteis de enzimas extracelulares fúngicas (REDDY e SREERAMULU, 2012). Enzimas como as celulases são utilizadas na hidrólise de substratos celulósicos e compreendem um complexo de enzimas celulolíticas compostas por endo-1,4-β-glucanase, exo-1,4-β-glucanase, β- glucosidase e exo-1,4-β- glucosidase (SADHU e MAITI, 2013). Esse grupo de enzimas são aplicadas em etapas de processos biotecnológicos em diversas áreas, incluindo biocombustíveis, produtos químicos, alimentos, bebidas, rações para animais, gêneros têxteis, papel e agricultura (PETZOLD; SCHWIKAL; HEINZE, 2006). Um dos parâmetros semiquantitativos usado para determinar a capacidade de produção de enzimas por micro-organismos é o índice de atividade enzimática (IE), esse, correlaciona o halo de degradação do substrato com a capacidade degradativa do micro-organismo testado (LIN et al., 1991). Para avaliação do potencial enzimático de fungos é recomendado que o valor de IE seja maior ou igual a 2,00 (STAMFORD; ARAÚJO e STAMFORD, 1998), ou seja, quanto maior for o IE de um fungo, maior será sua atividade enzimática extracelular (OLIVEIRA et al., 2006). Com isso, o presente estudo teve como objetivo isolar os fungos filamentosos presentes no processo fermentativo do cacau do Município de Tucumã, PA e avaliar o potencial enzimático de cada isolado na atividade celulolítica.
Material e métodos
Coleta das amostras As amostras foram coletadas em Tucumã, município brasileiro do interior do estado do Pará. A coleta foi realizada nos tempos 0, 24, 48, 72, 96, 120, 144 e 168 horas de fermentação. De cada tempo foram coletadas três amostras (em cochos distintos) contendo cada uma cerca de 200 g de sementes de cacau, totalizando assim, 24 unidades experimentais com aproximadamente 5 kg. As amostras foram acondicionadas em sacos de polietileno estéreis e transportadas em caixas isotérmicas contendo gelo para o Laboratório de Microbiologia de Alimentos - PPGCTA/UFPA onde foram armazenadas a 4 °C até a realização das análises. Isolamento dos fungos filamentosos Foram realizadas diluições decimais (10-1 a 10-7) seriadas de alíquotas das amostras de cacau em água peptonada tamponada à 1%. A partir das diluições foi realizado um plaqueamento em Ágar Batata Dextrose (BDA) acidificado a 10% com ácido tartárico e adicionado de cloranfenicol, pela técnica spread-plate (inoculação em superfície). As placas foram incubadas a 30 °C em estufa de crescimento microbiano durante 7 dias (APHA, 2001). Após o período de incubação, os fungos filamentosos que apresentaram características morfológicas macroscópicas (cor, produção de esporos e crescimento micelial) diferentes foram isolados. O isolamento do fungo foi realizado através de repiques de fragmentos de ágar BDA contendo micélio do fungo até obtenção de culturas visualmente puras. Potencial celulolítico dos fungos filamentosos Foi avaliado de acordo com a metodologia de Teather e Wood (1982) com modificações. O meio constituiu de 2,0 g.L-1 de NaNO3; 1,0 g.L-1 de KH2PO4; 0,5 g.L-1 de MgSO4.7H2O; 0,5 g.L-1 de KCl; 0,01 g.L-1 de Fe2SO4; 15,0 g.L-1 de ágar; como única fonte de carbono foi utilizado 10,0 g.L-1 de carboximetilcelulose. O pH inicial do meio foi ajustado para 5.0 e posteriormente o meio foi esterilizado em autoclave a 121 °C por 15 minutos. 20 mL do meio foram vertidos em placas estéreis. Cada fungo filamentoso previamente isolado foi repicado para uma placa contendo o meio ágar sal mineral solidificado. As placas foram incubadas em estufa de crescimento microbiano a 30 ºC durante três dias. Após a incubação foi adicionado 15 mL de solução de Vermelho Congo a 0,1% na superfície das placas onde permaneceu durante 30 minutos. Logo após, a solução de vermelho congo foi descartada e adicionada em cada placa 15 mL de NaOH 1 N por 10 minutos. Finalmente o NaOH 1 N foi também descartada e a coloração das placas foi analisada observando a formação de zonas claras ou amareladas/avermelhadas em torno dos fungos inoculados. O Índice Enzimático - IE foi obtido mediante a relação entre o diâmetro médio do halo de degradação e o diâmetro médio do micélio do fungo filamentoso. Análises estatísticas As diferenças entre as médias foram avaliadas pelo teste de comparação múltipla de Tukey (p<0,05). As análises estatísticas foram efetivadas utilizando-se o software Statistica versão 10.0
Resultado e discussão
Foram isolados um total de 25 fungos
filamentosos com diferentes
características morfológicas macroscópicas. Cada
isolado foi codificado em
FF (Fungo Filamentoso) + um algarismo numérico.
Na Tabela 1 encontram-se os resultados
obtidos do potencial enzimático
dos fungos filamentosos na atividade
extracelular da enzima celulase. Os
resultados demostraram que apenas os isolados
FF04, FF11, FF13 e FF18 não
apresentaram atividade celulolítica. 68% dos
fungos filamentosos isolados
apresentaram IE entre 1,0 e 1,7, não sendo
considerados bons produtores de
celulase.
Conforme Stamford; Araújo e Stamford (1998)
um fungo filamentoso para ser
considerado um potencial produtor de determinada
enzima extracelular ele
deve apresentar IE igual ou superior a 2,0, com
isso, apenas os isolados
FF03, FF05, FF10 e FF21 (Figura 1) se destacaram
na produção extracelular
dessa enzima, apresentando os maiores índices
enzimáticos. Não foi
encontrado na literatura pesquisas que
descrevessem o potencial enzimático
na atividade celulolítica dos fungos filamentos
isolados da fermentação do
cacau, no entanto, vários estudos relatam o
potencial de fungos filamentosos
isolados de outras fontes.
De acordo com Singhania et al. (2010) os
fungos filamentosos são as
maiores fontes de celulases e hemicelulases. E
para Ruegger e
Tank¬tornisielo, (2004) a maioria das celulases
comerciais são produzidas
por fungos filamentosos do gênero Trichoderma,
Penicillium e Aspergillus.
Com isso, os isolados que apresentaram bom
potencial enzimático na atividade
celulolítica possivelmente pertencem a esses
gêneros de fungos.
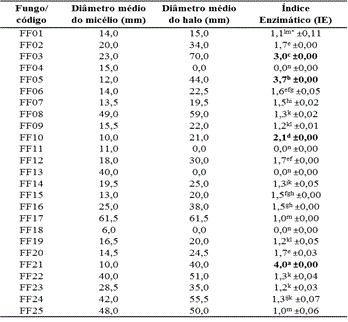
(*) Médias seguidas da mesma letra não diferiram estatisticamente em nível de 5% de probabilidade pelo teste de Tukey; Fonte: Dados da pesquisa

CON – Placa controle Fonte: Acervo pessoal
Conclusões
A maioria dos fungos filamentosos isolados da fermentação do cacau em Tucumã, PA apresentam atividade extracelular na produção de celulases, no entanto, somente quatro dos isolados foram considerados potenciais produtores de celulase, enzima essa de grande aplicabilidade nas indústrias de papel, químicas e alimentos.
Agradecimentos
A CAPES pela concessão da bolsa de estudos e ao ITV pelo financiamento do projeto.
Referências
APHA. American Public Health Association. Compendium of Methods for the Microbiological Examination of Foods. 4th ed. Washington, 2001.
COELHO, R. R. R.; NASCIMENTO, R. P. Seleção de actinomicetos produtores de enzimas de interesse biotecnológico. In: BON, E. P. S.; FERRARA, M. A.; CORVO, M. L. Enzimas em biotecnologia: produção, aplicação e mercado. Rio de Janeiro: Interciência, p. 71-94, 2008.
LIN, J. E.; CHANG, D. C. N.; SHEN, G. J. Correlations among several screening methods used for identifying Wood-decad fungi that can degrade toxic chemical. Biotechnolofy techniques, Kew, v. 5, n. 4, p. 275-280, 1991.
LOPEZ, A. S. Chemical changes occurring during the processing of cacao. In: Symposium Cacao Biotechnology. Proceedings. University Park: The Pennsylvania State University, Pennsylvania, p. 19-54, 1986.
MADIGAN, M. T., MARTINKO, J. M. e PARKER, J. (2004) Microbiologia de Brock. São Paulo: Prentice Hall. 10 ed. 608p.
MORENO, M. L.; PÉREZ, D.; GARCÍA, M. T; MELLADO, E. Halophilic bacteria as a source of novel hydrolytic enzymes. Life, v. 3, n. 1 p. 38-51, 2013.
OLIVEIRA, A. N.; OLIVEIRA, L. A.; ANDRADE, J. S.; CHAGAS-JUNIOR. A. F. Hidrolíticas Extracelulares de isolados de Rizóbia nativos da Amazônia central, Amazonas, Brasil. Ciência e Tecnologia de Alimentos. Campinas. v. 26. n. 4, p. 853-860, 2006.
PETZOLD, K.; SCHWIKAL, K.; HEINZE, T. Carboxymethyl xylan – Synthesis and detailed structure characterization. Carbohydrate Polymers, v. 64, p. 292–298, 2006.
REDDY, P. L.; SREERAMULU, A. Isolation, identification and screening of pectinolytic fungi from different soil sam¬ples of Chittoor district. International Journal of Life Sciences Biotechnology and Pharma Research, v. 1, n. 3, p. 186-193, 2012.
ROSA, C. A. R.; CAMPOS, S. G.; BARONI, F. A. Práticas de micologia veterinária. UFRRJ. Instituto de Veterinária. Departamento de Micologia e Imunologia Veterinária. Micologia Veterinária. Prática 8. Seropédica, 2002.
RUEGGER, M. J. S.; E TAUK-TORNISIELO, S. M. Atividade da celulase de fungos isolados do solo da Estação Ecológica de Juréia-Itatins, São Paulo, Brasil. Revista Brasileira de Botânica, v. 27, n. 2, p. 205-211. 2004.
SADHU, S.; MAITI, T. K. “Cellulase production by bacteria: a review,” British Microbiology Research Journal, v. 3, n. 3, p. 235–258, 2013.
SANTOS, D. S.; Inoculação de leveduras start na fermentação do cacau para melhoria do flavor. 2010. 82p. Dissertação (Mestrado) – Universidade Estadual de Santa Cruz, Santa Cruz, SP.
SINGHANIA, R.R.; SUKUMARAN, R.K.; PATEL, A.K.; LARROCHE, C.; PANDEY, A. Advancement and comparative profiles in the production technologies using solid-state and submerged fermentation for microbial cellulases.Enzyme and Microbial Technology, v.46, p.541-549, 2010.
STAMFORD, T. L. M.; ARAUJO, J. M.; STAMFORD, N. P. Atividade enzimática de microrganismos isolados dobjacarupé (Pachyrhizus erous L. Urban). Ciência e Tecnologia de Alimentos, v. 18, n. 4, p. 382-385, 1998.
TEATHER, R. M.; WOOD, P. J. Use of Congo red-polysaccharide interactions in enumeration and characterization of cellulolytic bacteria from the bovine rumen. Applied and Environmental Microbiology. v. 43, p. 777–780, 1982.











