ISBN 978-85-85905-15-6
Área
Iniciação Científica
Autores
de Rezende, C.H.A. (CCET/UEG) ; de Almeida, P.H.G. (CCET/UEG) ; Magalhães, B.O. (CCET/UEG) ; Andrade, C.C. (CCET/UEG) ; Costa, M.B. (CCET/UEG)
Resumo
Guanidinas são substâncias puras e cristalinas amplamente pesquisadas e empregadas como catalisadores ou intermediários sintéticos (TAN; COLES, 2014), por possuírem propriedades doadoras de elétrons (WONG et al.,2010), além de um amplo espectro de atividades biológicas (anti-helmíntico, anti- histaminíco, anti-diabético, antibacteriano) (CUNHA et al.,2001). Diversas guanidinas já foram sintetizadas em uma variedade de metodologias sintéticas (CUNHA et al., 2001; BERLINCK et al., 2012; O’DONOVAN et al, 2013). Visando aumentar este leque de guanidinas funcionalizadas, o objetivo deste trabalho foi sintetizar guanidinas N,N-dissubstituídas, com uma variedade de grupos funcionais, doadores ou retiradores de elétrons, para posterior aplicação em reações multicomponentes e avaliação biológica.
Palavras chaves
síntese; guanilação; guanidinas
Introdução
Guanidinas, substâncias nitrogenadas presentes em muitos produtos naturais, podem ser isolados de algas, esponjas e microrganismos (WONG, 2010). Seu caráter básico direciona para que possam ser facilmente protonadas em pH fisiológico, e consequentemente existirem na forma iônica, como um excelente reconhecedor de substratos aniônicos, tais como carboxilatos, fosfatos e nitros (CAI, 2013). O seu amplo espectro de atividades biológicas (anti-helmíntico, anti- histaminíco, anti-diabético, antibacteriano e etc) faz com que as guanidinas sejam um interessante alvo sintético para muitos grupos de pesquisa, por auxiliar na produção de novas substâncias, muitas delas com potencial biológico (JAYAKUMAR; GELETA, 2014). Porém, outro ponto importante a ser destacado é a limitação sintética dos substituintes presentes nas guanidinas. Para favorecer a síntese, os mesmos devem ser eletronicamente e estericamente neutros (CUNHA et al., 2001). A síntese de guanidinas a partir de tioureias, com diferentes catalisadores, aminas primárias e secundárias são as estratégias mais utilizadas para a construção da funcionalidade guanidínica (CRUZ, et al.,2012). Dando continuidade às pesquisas realizadas em nosso laboratório para obter substâncias nitrogenadas potencialmente ativas, nosso grupo de pesquisa vem sintetizando guanidinas N,N-substituídas, com variação de grupos funcionais, para subsequente avaliação da influência destes substituintes em sua síntese e, principalmente, no emprego em reações para a obtenção de substâncias N- heterocíclicas funcionalizadas.
Material e métodos
A parte experimental foi executada na Universidade Estadual de Goiás – Campus de Ciências Exatas e Tecnológicas Henrique Santillo. Os reagentes e solventes P. A. foram utilizados sem purificação prévia. A Cromatografia em Camada Delgada (CCD) foi realizada em placa de alumínio com 0,20 mm de sílica gel 60 com indicador de fluorescência UV254 (Macherey- Nagel). Os espectros de infravermelho (IV) foram registrados no espectrômetro Spectrum Frontier (Perkin Elmer). *Procedimento geral para a síntese de guanidinas: - As tiouréias utilizadas neste estudo foram preparadas de acordo com a metodologia adaptada de Cunha e Colaboradores (2001) e O’Donovan e Colaboradores (2013) e submetidas as reações de guanilação. À solução de tiouréia (5,0 mmol) em 15 mL de CH2Cl2, foram adicionados a amina (5,0 mmol), trietilamina (6,0 mmol) e cloreto de mercúrio (3,0 mmol) com agitação magnética vigorosa e banho de gelo durante os primeiros minutos. A reação procedeu-se por 48 horas em temperatura ambiente. Após este período, adicionou-se 30 mL de acetato de etila e procedeu-se com filtração á vácuo em funil sinterizado sob celite. Foram utilizados mais 30 mL de acetato de etila para lavar a celite e retirar possíveis resquícios do produto. Sequencialmente, o filtrado foi lavado com água destilada (2 X 50 mL), salina (1 X 25 mL), seca em sulfato de sódio anidro e concentrado em evaporador rotativo. O produto bruto foi submetido à coluna cromatográfica por gravidade, empacotada com sílica gel 230-400 mesh e eluída com hexano/acetato de etila 25%. Após purificação, o ponto de fusão, das guanidinas, foi determinado sem correção e os rendimentos variaram de 50 a 95%.
Resultado e discussão
Diversos são os catalisadores que podem ser empregados em reações de
guanilação (Esquema 1), para o favorecimento da formação do intermediário
carbodiimida, proveniente do ataque nucleofílico da amina (primária ou
secundária) no centro eletrofílico da ligação C=S da tiouréia. Dentre eles
podemos citar o HgCl2 e o Bi(NO3)3.5H2O (CUNHA et al., 2006). Apesar da
toxicidade do HgCl2, neste trabalho ele foi empregado pela disponibilidade e
por apresentar tempo reacional menor do que com o emprego de outros
catalisadores.
A escolha dos grupos funcionais foi feita, com objetivo de se ter diferentes
guanidinas funcionalizadas, com grupos doadores e/ou retiradores, para o
estudo da influencia estereo-eletrônica na síntese das guanidinas e,
principalmente das substâncias N-heterocíclicas. Estudos já desenvolvidos
evidenciaram que grupos N-benzoil nas tiouréias não interferem no mecanismo
de guanilação (CUNHA et al., 2001). No atual estudo, a mudança para os
grupos etoxicarbonil e alil, não interferiram no resultado dos processos de
guanilação. Porém, o emprego de aminas secundárias e impedidas estericamente
evidenciou rendimentos baixos (45-50%).
A elucidação dos produtos obtidos foi realizada pela análise de absorção na
região do infravermelho, que evidenciou, além dos grupos funcionais
provenientes dos isotiocianatos e das aminas, bandas de absorção com
estiramentos característicos do grupo guanidínico (3480-3400 cm-1 (NH ou
NH2); 1680-1550 cm-1 (C=N, com variação nos valores das frequências devido à
presença de grupos retiradores, doadores e conjugação de elétrons); 1330-
1210 cm-1 grupo C-N, com variação nos valores das frequências devido à
presença de grupos aromáticos, alifáticos).
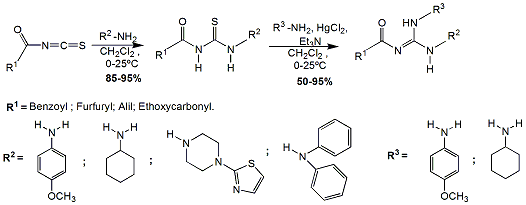
Síntese de Guanidinas
Conclusões
Os processos realizados para a obtenção das tioureias foram administrados dentro dos parâmetros laboratoriais e condições reacionais adequadas, o quê gerou rendimentos satisfatórios. Em sequência, os estudos corroboraram para a produção de novas guanidinas com diferentes grupos funcionais e para uma abordagem farmacológica das mesmas, uma vez que as guanidinas possuem um amplo espectro de atividades biológicas. Pode-se notar que os efeitos estereoletrônicos não impediram que as guanilações ocorressem. Ajustes na metodologia serão aplicados e os espectros de RMN estão sob análise.
Agradecimentos
A CAPES e CNPq pelas bolsas fornecidas, a UEG pelo apoio e ao grupo de pesquisa LabSIMCO.
Referências
BERLINCK, R.G.S.; TRINDADE-SILVA, A. E.; SANTOS, M.F.C., Natural Product Reports, v. 29, p.1382-1406, 2012.
CAI, Z. S.; SUN, Y. M.; ZHU, X. M.; ZHAO, L. L.; YUE, G. Y., Polymers Bulletin, V. 70, p.1085-1096, 2013.
CORTEZ, Douglas Henrique Cardoso. Dissertação de Mestrado, UFSC, Florianópolis, SC, 2013.
CUNHA, S. D.; COSTA, M. B.; NAPOLITANO, H. B.; LARIUCCI, C.; VENCATO, I., Tetrahedron, V. 57, p. 1671-1675, 2001.
CUNHA, S.; RODRIGUES JR, M. T., Tetrahedron Letters, v. 47, p. 6955-6956, 2006.
CRUZ, A.; MARTÍNEZ, I. I. P.; BÁEZ, E.V.G., Molecules, v.17, p. 10178-10191, 2012.
DIAS, A.; CORRÊA, A. G.; Química Nova, V.24, p. 236-242, 2001.
GUIDO, R. V. C. - ANDRICOPULO D. A.; OLIVA, G., Química Nova, São Paulo, v. 24, 2010.
JAYAKUMAR, V.; GELETA, G. S., Journal of Chemical Sciences, v. 4, n. 10, p. 48-53, 2014.
O’DONOVAN, D.H.; ROZAS, I, Tetrahedron Letters, v. 52, p. 4117-4119, 2011
SILVA, P.B.G.; VICALVI, M.C.V.; EGITO, M.S., SOLIDÔNIO, E.G.; SENA, K.X.F.R.; ALBUQUERQUE, J.F.C., 53º Congresso Brasileiro de Química. Realizado no Rio de Janeiro/RJ, 2013.
TAN, C. H.; COLES, M., Australian Journal Chemistry, v.67, p.963–964, 2014.
WONG, F. F.; CHEN, C. Y.; LIN, H. C.; HUANG, Y. Y.; CHEN, K. L.; HUANG, J. J.; YEH, M. Y., Tetrahedron, V. 66, p. 1892-1897, 2010


















