ISBN 978-85-85905-15-6
Área
Iniciação Científica
Autores
Oliveira, I.N. (CCET/UEG) ; Silva, K.K.S. (CCET/UEG) ; Morais, C.C. (CCET/UEG) ; Rosseto, R. (CCET/UEG)
Resumo
Ácido acetilsalicílico (AAS) é um anti-inflamatório não esteroidal popularmente comercializado como analgésico, antipirético, na prevenção e tratamento de doenças reumáticas e cardiovasculares. Entretanto, quando administrado diretamente, pode apresentar efeitos colaterais indesejáveis no sistema gastrointestinal. A busca por sistemas que auxiliam na liberação controlada e que diminuam os efeitos colaterais indesejáveis de fármacos é necessária, sendo os hidróxidos duplos lamelares (HDL) uma alternativa viável como matriz hospedeira. O presente trabalho teve como objetivo a incorporação do AAS em HDL Ca/Fe, e o estudo da dessorção do fármaco em solução aquosa. Constatou-se que a liberação do AAS do HDL-AAS foi sustentada e gradativa em um período de até 6 h.
Palavras chaves
Aspirina; Argilas aniônicas; Liberação controlada
Introdução
Tradicionalmente, ácido acetilsalicílico (AAS) é utilizado como antipirético, analgésico e anti- inflamatório, sendo comercializado com o nome de Aspirina. Vários estudos clínicos prescrevem o uso do AAS na prevenção e tratamento de doenças coronárias, trombose cerebral, reumatismo, coágulos sanguíneos, entre outros. Entretanto, a administração oral prolongada de AAS é associada a severas irritações na mucosa gastrointestinal, provocando vômitos, úlceras e sangramentos, devido ao caráter ácido do fármaco. Outra limitação do AAS refere-se à sua baixa solubilidade em condições ácidas estomacais, o que dificulta a absorção do medicamento pelo organismo (GOU et al., 2013). O emprego de matrizes hospedeiras para a liberação controlada, o aumento de solubilidade e a proteção físico-química de fármacos é amplamente empregada, destacando-se sistemas que utilizam polissacarídeos, celulose, quitosana, fosfolipídios, e matrizes inorgânicas como sílica, nanotubos e óxido de ferro (SAFARI, ZANERGAR, 2014). Neste contexto, hidróxidos duplos lamelares (HDL), ou argilas aniônicas, atuam como uma alternativa viável no carreamento de fármacos (KHAN et al., 2009). A região interlamelar dos HDL tem a capacidade de acomodar uma série de ânions e água, alterando o ambiente físico- químico do fármaco, podendo acentuar a molhabilidade, além de servir de proteção entre o princípio ativo e o alvo no organismo a ser atingido (CUNHA et al., 2010). Os HDL também podem exibir alta biocompatibilidade, sendo obtidos por rotas sintéticas simples de custos reduzidos. Trabalhos que empregam HDL como carreadores de uma série de compostos são encontrados na literatura, mas o desafio é a obtenção de híbridos HDL-fármaco que apresentem uma liberação gradativa e sustentada do princípio ativo (BI et al., 2014).
Material e métodos
O HDL Ca/Fe (razão molar 2:1) foi sintetizado a partir do método de coprecipitação de acordo com a literatura com modificações (KHAN et al., 2009). Foram utilizados 0,05 mol de CaCl2.2H2O e 0,025 mol de FeCl3.6H2O em 50 mL de água destilada. Essa mistura foi adicionada lentamente a uma solução de 0,16 mol de NaOH em 100 mL de água destilada. A mistura foi colocada sob agitação a 25 °C por 48 h. O produto foi filtrado à pressão reduzida, lavado com água destilada (700 mL) e seco a 100 °C por 90 min, obtendo um sólido de coloração marrom. A incorporação do AAS ao HDL Ca/Fe foi realizada a partir de uma dispersão de 1 g de AAS e 0,3 g de HDL Ca/Fe em 100 mL de água sob agitação a 60ºC por 48 h. O precipitado foi filtrado à pressão reduzida, lavado com água destilada (300 mL) e seco a 100ºC por 1 h para se obter um sólido de cor marrom- escuro/roxo (HDL-AAS). As cinéticas de liberação do HDL-AAS foram acompanhadas no espectrofotômetro UV- vis Perkin Elmer Lambda 25, a partir de dispersões de 5 mg de HDL-AAS em 100 mL de água, monitorando a evolução da banda em 298 nm. Para a quantificação do AAS no HDL-AAS foram preparadas soluções do AAS em 0,1 mol L-1 de NaOH e feita uma curva padrão, comparando com os valores das cinéticas. A amostra preparada foi caracterizada por espectroscopia vibracional no infravermelho por refletância atenuada (ATR).
Resultado e discussão
Os espectros na região do
infravermelho do HDL Ca/Fe e HDL-AAS
mostraram
bandas características na região de
3400 cm-1 (estiramentos OH), 1600 cm-1
(água interlamelar) e 1450 cm-1
(presença de carbonato). Para HDL-AAS
constatou-se estiramento largo próximo
a 1670 cm-1 atribuído às ligações C=O
do AAS no híbrido, ligeiramente
deslocado quando comparado com o AAS
puro
(carbonilas em 1750 e 1680 cm-1). A
partir dos espectros eletrônicos no
UV-
vis em diferentes concentrações de AAS
em NaOH e de HDL-AAS em água,
estimou-se que a quantidade de AAS em
HDL-AAS foi de 60% m/m.
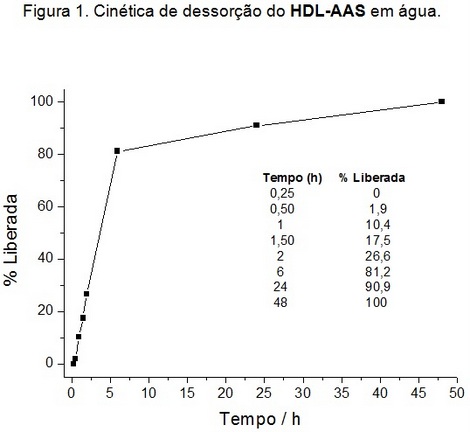
O sistema HDL-AAS em água mostrou-se
altamente dispersável, não observando
decantação do sólido durante as horas
iniciais da cinética de liberação. A
dessorção do AAS da matriz inorgânica
ocorreu de forma gradativa e linear
até aproximadamente 6 h (Figura 1),
tempo bastante superior comparado com
sistemas análogos descritos na
literatura, que descrevem liberações
superiores a 90% entre 60 e 120 min de
cinética (GOU et al., 2013).
Conclusões
A dessorção do AAS no híbrido preparado demonstra que o HDL Ca/Fe é um candidato em potencial para a obtenção de formulações que visam a liberação prolongada de princípios ativos.
Agradecimentos
À Universidade Estadual de Goiás pelo Programa de Bolsa de Incentivo à Pesquisa e Produção Científica (PROBIP-UEG).
Referências
BI, X.; ZHANG, H.; DOU, L. 2014. Layered double hydroxide-based nanocarriers for drug delivery. Pharmaceutics 6: 298-332.
CUNHA, V.R.R.; FERREIRA, C.M.A.; CONSTANTINO, V.L.R. 2010. Hidróxidos duplos lamelares: Nanopartículas inorgânicas para armazenamento e liberação de espécies de interesse biológico e terapêutico. Química Nova 33: 159-171.
GOU, G.; DONG, L.; JIAO, L. 2013. Characterization of a dextran–coated layered double hydroxide acetylsalicylic acid delivery system and its pharmacokinetics in rabbit. Acta Pharmaceutica Sinica B 6:400–407.
KHAN, A.; RAGAVAN, A.; FONG, B.; O’HARE, D. 2009. Recent developments in the use of layered double hydroxides as host materials for the storage and triggered release of functional anions. Industrial Engineering Chemical Research 48: 10196-10205.
SAFARI, J.; ZARNEGAR, Z. Advanced drug delivery systems: Nanotechnology of health design. A review. 2014. Journal of Saudi Chemical Society 18: 85-99.


















