ISBN 978-85-85905-15-6
Área
Iniciação Científica
Autores
Campos, J.D.R. (UEG) ; Alves, D.M.S. (UEG) ; Oliveira, H.C.B. (UNB)
Resumo
Complexos de cobalto possuem efeitos antivirais e bactericidas. A alteração dos ligantes pode levar ao aumento ou diminuição dessas propriedades.Foram sintetizados dois complexos de coordenação isômeros de ligação Co(NH3)5ONO]Cl2 e [Co(NH3)5NO2]Cl2, sendo o complexo com o ligante NO2 o isômero mais estável.O complexo [Co(NH3)5NO2]Cl2 foi exposto a radiação ultravioleta (UV) por 40min, sendo obtidos espectros no infravermelho (FT- IR) a cada 10 min. Observou-se que conforme aumentava-se o tempo de exposição à radiação UV as bandas de 1428cm-1 e 1309cm-1 do complexo [Co(NH3)5NO2]Cl2 diminuíam, enquanto que as bandas em 1454cm-1 e 1070cm-1 do complexo [Co(NH3)5ONO]Cl2 aumentavam. Após 40min o complexo [Co(NH3)5NO2]Cl2 foi totalmente isomerizado a Co(NH3)5ONO]Cl2.
Palavras chaves
cobalto; isomerização; ultravioleta
Introdução
Complexos de cobalto possuem efeitos antivirais e bactericidas. A alteração dos ligantes pode levar ao aumento ou diminuição dessas propriedades (CHANG et al, 2010). Complexos de cobalto contendo ligantes NH3 foram estudados por Werner em 1893, mostrando que isômeros de posição apresentavam colorações diferentes. A coordenação do ligante NO2 em metais de transição da primeira e segunda série da tabela periódica é objeto de pesquisa em química inorgânica. A isomerização nitrito(ONO)–nitro(NO2) é um tipo de isomeria de ligação que ocorre em complexos de Co3+. Podem ser obtidos tanto por síntese ou por interconverção de acordo com a influência de alguns fatores como temperatura e radiação ultravioleta. Nos complexos cloreto de nitropentaaminocobalto (III) ([Co(NH3)5NO2]Cl2) e cloreto de nitritopentaaminocobalto (III) ([Co(NH3)5ONO]Cl2) o íon NO2- coordena-se de duas formas diferentes ao centro metálico, no primeiro caso pelo átomo de nitrogênio e no segundo pelo átomo de oxigênio, sendo denominados isômeros de ligação (CIOFINI, ADAMO, 2001). Este tipo de isomerização pode ocorrer tanto em solução, quanto no próprio estado sólido. O complexo [Co(NH3)5ONO]Cl2 é mais difícil de ser isolado, pois mesmo a baixas temperaturas ele se converte em [Co(NH3)5(NO2)]Cl2, o qual, por sua vez, somente se converte ao isômero [Co(NH3)5ONO]Cl2 mediante exposição à radiação ultravioleta (ESLAMI et al., 2004). O objetivo deste trabalho é estudar a variação do tempo de exposição do complexo [Co(NH3)5(NO2)]Cl2 à radiação ultravioleta para se isomerizar ao complexo [Co(NH3)5ONO]Cl2.
Material e métodos
Síntese do [Co(NH3)5NO2]Cl2: Preparou-se solução com 25mL de água destilada, 2mL de amônia concentrada e 2,0g do complexo [Co(NH3)5Cl]Cl2 (previamente sintetizado). A solução foi aquecida a 60°C, filtrada a quente, resfriada a temperatura ambiente e neutralizada com solução de ácido clorídrico 6 mol/L. Foram adicionados 3,0g de nitrito de sódio sólido à solução, a qual foi aquecida a 60°C para dissolução completa do sólido. A solução foi resfriada a temperatura ambiente e adicionou-se 35mL de HCl concentrado. A solução foi resfriada em banho de gelo, filtrada e os cristais lavados com pequenas porções de água gelada, álcool etílico e éter. Síntese do [Co(NH3)5ONO]Cl2: Preparou-se solução contendo 20mL de água destilada, 5mL de amônia concentrada e 1,0g do complexo [Co(NH3)5Cl]Cl2. A solução foi aquecida a 60°C, filtrada a quente, resfriada a temperatura ambiente e neutralizada com solução de HCl 6 mol/L. Foram adicionados 1,50g de nitrito de sódio e 1,5mL de ácido clorídrico 6,0mol/L, sob agitação. A solução será resfriada em banho de gelo, filtrada e os cristais lavados com pequenas porções de água gelada, álcool etílico e éter. Estudo de isomerização: O complexo [Co(NH3)NO2]Cl2 foi misturado com KBr e prensado, obtendo-se uma pastilha. Em seguida, a pastilha foi exposta a radiação ultravioleta oriunda de uma lâmpada de vapor de mercúrio de 125W por 40min. A cada 10min, a fonte de radiação era desligada e o complexo analisado por espectroscopia no infravermelho em um FT-IR/NIR-Spectrometer Perkin Elmer modelo Frontier.
Resultado e discussão
Os espectros no infravermelho (FT-IR) do complexo [Co(NH3)5NO2]Cl2 expostos
à radiação ultravioleta em função do tempo de exposição são mostrados na
Figura 1. O espectro no infravermelho do complexo [Co(NH3)5NO2]Cl2 (espectro
em rosa) apresenta duas bandas intensas em 1428cm-1 e 1309cm-1, referentes
aos estiramentos NO assimétrico e simétrico, respectivamente. Após 10min de
exposição do complexo à radiação ultravioleta (espectro em preto), observa-
se o aparecimento de duas novas bandas centralizadas em 1454cm-1 e 1070cm-1,
referentes aos estiramentos NO assimétrico e simétrico do complexo [Co(NH3)5
ONO]Cl2, respectivamente. Observa-se também a diminuição das bandas de
1428cm-1 e 1310cm-1. Com o aumento do tempo de exposição, as bandas de
1428cm-1 e 1310cm-1 diminuem mais ainda sua intensidade e a banda de 1462cm-
1 e 1050cm-1 ficam cada vez mais intensa. Com 40min de exposição (espectro
em verde), a banda 1428cm-1 referente ao complexo [Co(NH3)5NO2]Cl2 é
totalmente extinta, mostrando que após este tempo o complexo
[Co(NH3)5NO2]Cl2 foi totalmente isomerizado a [Co(NH3)5ONO]Cl2. O mecanismo
de isomerização intramolecular no estado sólido do complexo [Co(NH3)5NO2]Cl2
ainda não está bem estabelecido. Diante deste fato, estudos teóricos
envolvendo estado excitado estão sendo desenvolvidos na tentativa de
elucidar este mecanismo.
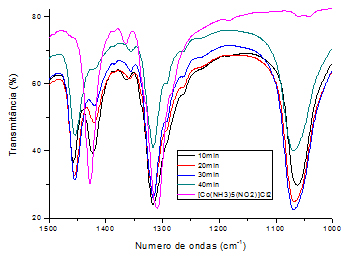
Espectros no infravermelho da fotoisomerização do complexo [Co(NH3)5NO2]Cl2 em função do tempo de exposição à radiação ultravioleta.
Conclusões
O [Co(NH3)5NO2]Cl2 quando exposto à radiação ultravioleta foi isomerizado ao seu isômero de ligação [Co(NH3)ONO]Cl2. Após 10min de exposição já foi possível se observar isomerização e com o aumento do tempo de exposição, observou-se por espectroscopia no infravermelho que as bandas referentes ao complexo de partida foram ficando menos intensas e do seu isômero, mais intensa. O tempo de exposição de 40min foi suficiente para isomerizar completamente o complexo [Co(NH3)5NO2]Cl2.
Agradecimentos
Agradecimento a bolsa BIP.
Referências
CHANG, E. L., SIMMERS, C., KNIGHT, D. A., Pharmaceuticals, 2010, 3, 1711
CIOFINI,I., ADAMO, C., J. Phys. Chem. A, 2001, 105, 1086
ESLAMI, A., Thermochimica Acta, 2004, 409, 189


















