ISBN 978-85-85905-10-1
Área
Ambiental
Autores
Barreto, J.P.P.B. (UFRN) ; Medeiros, M.O.M. (UFRN) ; Santos, E.V.S. (UFRN) ; Sousa, J.F.S. (UFRN) ; Silva, D.R.S. (UFRN) ; Martinez-huitle, C.A.M. (UFRN)
Resumo
A oxidação eletroquímica foi utilizada para investigar a degradação do fenol sendo empregado eletrodo de Ti/IrO2. A eletrolise ocorreu sob condições galvanostáticas, aplicando diferentes densidades de correntes (10, 20 e 30 mA cm-2), visando avaliar o comportamento da eficiência do processo, além do efeito da quantidade de NaCl dissolvido, a fim de determinar sua influencia na reação de evolução de cloro ativo e na oxidação do fenol. Análise de UV-visível foi realizada para as diferentes concentrações de Cl-, com densidade de corrente 20 mA cm−2. Durante a degradação eletroquímica do fenol foi observada a formação de intermediários, e esses foram quantificados mediante o uso da técnica de HPLC. Os resultados mostram eficiente durante a degradação do fenol removendo 84%.
Palavras chaves
Fenol; Oxidação eletroquímica; cloretos
Introdução
Os fenóis são compostos aromáticos que contêm um ou mais grupos hidroxilas ligados ao anel aromático e produzido como resíduos em uma variedade de indústrias, incluindo refinárias de petróleo, corantes, plásticos, produtos farmacêuticos e as plantas de coque. Compostos fenólicos são bastante resistentes à degradação biológica em estações de tratamento de água residuárias. O seu tratamento tem sido um desafio em função da complexidade e do impacto ambiental gerado. Diversos métodos são empregados para o tratamento desses efluentes, tais como adsorção (CHEN et al., 2014) oxidação química, fotocatálise, tratamento biológico e ozonização (MARTÍNEZ-HUITLE; FERRO, 2006). De acordo com a resolução (CONAMA 357, 2005) a quantidade máxima de fenóis nos efluentes de qualquer fonte poluidora não devem ultrapassar o valor de 0,5 mg L- 1 para que possam ser descartados nos corpos d’água. O método mais popular para desinfecção eletroquímica é a eletrocloração. A principal vantagem é geração in- situ de desinfetantes, porém o principal problema da cloração está no transporte e armazenamento de cloro ativo por ser tóxico. As espécies de cloro ativo tais como Cl2, HOCl, OCl e ClO2 são amplamente utilizadas como principais oxidantes pela inativação de células de eletrocloração (BONFATTI et al., 2000 e CHATZISYMEON et al., 2010). Assim, neste trabalho foi utilizada a oxidação eletroquímica mediada com íons Cl- como alternativa para degradação de fenol e avaliação dos possíveis intermediários formados durante o processo eletroquímico utilizando o Ti/IrO2 como material eletrocatalítico.
Material e métodos
Neste trabalho foi utilizada a oxidação eletroquímica como alternativa para a remoção do fenol, presente numa solução sintética, utilizando eletrodo Ti/IrO2 com área superficial de 63,5 cm2 em uma célula eletroquímica em fluxo. Para circulação do efluente através do reservatório e reator eletroquímico, uma bomba peristáltica foi instalada, com uma taxa de 151 dm3 h-1. O coeficiente de transferência de massa para o reator eletroquimico foi de 2,0 × 10-5 m s-1 (determinado usando o ferri/ferro-cianeto). A fim de obter as melhores condições para degradação eletroquímica do fenol, vários experimentos foram realizados nas seguintes condições: densidade de corrente aplicada j=10, 20 e 30 mA cm-2, variando a concentração do eletrólito suporte de 20 mM Cl- e 30 mM Cl-. Durante o estudo foi monitorado a remoção de fenol via espectrofotometria no UV-Visível, em 230 nm, comprimento de onda característico de absorção da molécula de fenol. Entretanto, nessas mesmas condições há formação de intermediários, o que pode ser confirmado através dos resultados da Demanda Química de Oxigênio (DQO) e via HPLC (High Performance Liquide Chromatography).
Resultado e discussão
A Figura 1a mostra que a DQO inicial da solução foi de 338 mg L-1 e, o
comportamento do material eletrocatalítico do Ti/IrO2. Foi observado que à
medida que aumenta a densidade de corrente(J) e a concentração dos íons Cl-
ocorre uma diminuição da DQO ao final do processo nas concentrações 20 mM de Cl-
(262 mg L-1; 182 mg L-1 e 140 mg L-1) e 30 mM de Cl- (193 mg L-1; 123 mg L-1 e
121 mg L-1) para J de 10; 20 e 30 mA cm-2, respectivamente, após 120 min de
tratamento. Tem sido proposto que os radicais •OH formados pela oxidação da água
(H2O → •OH + H++е-) podem ser oxidados eletroquimicamente para dioxigénio (•OH →
½ O2 + H+ + е-) ou contribuir para a oxidação de compostos orgânicos, neste
caso, o fenol (Fenol → CO2+H2O). Na Figura 1b e 1c são apresentadas as
absorbâncias para examinar o efeito do potencial de oxidação do fenol mediante a
presença dos íons cloretos. Nas concentrações de 20 e 30 mM de Cl- produziu
espécies com picos de absorção em 263 nm, a presença do cloreto resultou na
formação de espécies cloradas formadas eletroquimicamente para a concentração de
Cl- de 30 mM com picos de absorção em 250 nm e 305 nm (NEODO, 2012). O
aparecimento desses picos está associado a produção de espécies cloradas
reativas tais como (Cl2, HClO e OCl-). No tratamento eletroquímico o pH variou
entre 5,5 e 6,2. Entretanto, •OH produzidos tendem a reagir rapidamente com íons
Cl- formando OCl- em pH (4 a 7). Sob estas condições, Cl2 é a espécie
predominante no meio quando o pH<3, HOCl para 3<pH<7,5 e ClO- para pH>7,5
(SANTOS, 2014).A Figura 2a e 2b mostra os perfis da concentração dos
intermediários durante a oxidação. Assim, o fenol pode ser transformado em
diferentes intermediários ou dióxido de carbono durante o processo, tais como
hidroquinona e catecol.
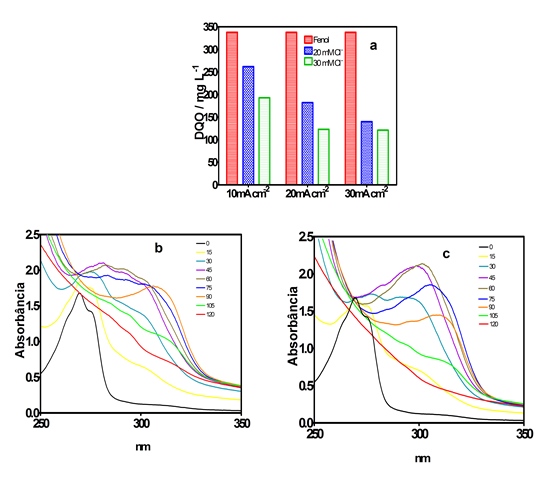
Figura 1: (a) Influência da densidade de corrente aplicada sobre a remoção de DQO em função do tempo e a concentração de Cl- durante eletroxidação do
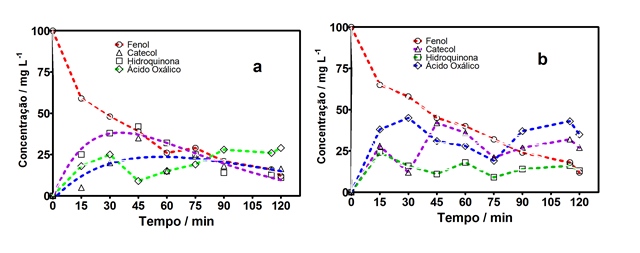
Identificação e quantificação dos intermediários formados. As condições de operacionais: j =20 mA cm-2, a temperatura T = 25°C. (a)20 mM Cl-,(b) 30 mM
Conclusões
O processo eletroquímico para a degradação eletroquímica do fenol utilizando o eletrodo de Ti/IrO2 mostrou-se eficiente pois várias espécies cloradas são geradas na oxidação eletroquímica, mediando o processo, reforçando a remoção da matéria orgânica. A eficiência de remoção do fenol foi de 84 % e 88% em 20 e 30 mM Cl- em 120 min. De um modo geral, a aplicação da oxidação eletroquímica mediada (produção de cloro ativo) pode ser considerada mais eficaz do que a oxidação direta devido a diminuição dos problemas relacionados a incrustações e/ou corrosão do eletrodo.
Agradecimentos
Ao Programa Petrobrás de Recursos Humanos (PRH-222).
Referências
CHEN, H. et al. Amination of activated carbon for enhancing phenol adsorption: Effect of nitrogen-containing functional groups. Applied Surface Science, v. 293, 2014, p.299-305.
RESOLUÇÃO 357.17 mar. 2005. Conselho Nacional de Meio Ambiente. BRASIL.
BONFATTI, F. et al. Anodic mineralization of organic substrates in chloride-containing aqueous media. ElectrochimicaActa, v. 46, 2000, p. 305-314.
MARTÍNEZ-HUITLE, C. A.; FERRO, S. Electrochemical oxidation of organic pollutants for the wastewater treatment: direct and indirect processes. Chemical Society Reviews, v. 35, 2006, p. 1324-1340.
CHATZISYMEON, Efthalia et al. Anodic oxidation of phenol on Ti/IrO2 electrode: Experimental studies. Catalysis Today. Matal, p. 185-189. abr. 2010.
NEODO, S. et al. On the electrolysis of dilute chloride solutions: Influence of the electrode material on Faradaic efficiency for active chlorine, chlorate and perchlorate. Electrochimica Acta, 2012, p. 282-291.
SANTOS, E.V. Scale-up of electrochemical oxidation system for treatment of produced water generated by Brazilian petrochemical industry. Environmental Science and Pollution Research International, v. 21, 2014, p. 8466 -8475.
PIMENTEL, Marcio et al. Phenol degradation by advanced electrochemical oxidation process electro-Fenton using a carbon felt cathode. Applied Catalysis B: Environmental. p. 140-149. set. 2008.










