ISBN 978-85-85905-10-1
Área
Ambiental
Autores
Correia de Velosa, A. (ESCOLA POLITÉCNICA - UNIVERSIDADE DE SAO PAULO) ; Augusto Oller do Nascimento, C. (ESCOLA POLITÉCNICA - UNIVERSIDADE DE SAO PAULO)
Resumo
A contaminação de águas subterrâneas é um grande problema enfrentado hoje pelo Brasil e pelo mundo. O persulfato tem surgido como novo oxidante para degradação de contaminantes orgânicos e neste trabalho foi avaliado na deradação de pentaclorofenol (PCP). Aqui estudou-se o efeito da concentração de persulfato, do pH do meio e da presença de Fe2+ e de Cu2+. O aumento do persulfato resultou em maior degradação de PCP, assim como a presença de Cu2+. O pH do meio, no entanto, não alterou a cinética da reação na ausência dos metais.
Palavras chaves
pentaclorofenol; persulfato; degradação
Introdução
O persulfato tem sido recentemente estudado como um agente oxidante alternativo para o tratamento de contaminações de solos e águas subterrâneas por compostos orgânicos. O ânion persulfato (S2O82-) pode ser ativado térmica ou quimicamente, por metais de transição ou meio alcalino, para a geração de radicais sulfato (SO4●-) que são oxidantes muito poderosos (potencial padrão de redução de 2,6 V) capazes de degradar vários compostos orgânicos (ZHAO et al, 2010, RASTOGIA et al, 2009). O persulfato de sódio, em particular, possui alta solubilidade em água gerando uma solução com densidade de 1,0104 g/mL, possibilitando injeçoes de grandes concentrações do reagente em subsuperfície. O persulfato é mais estável em subsuperfície do que o H2O2 e pode persistir neste ambiente por semanas. Como o ânion persulfato não sofre grande adsorção no solo ele acaba sendo móvel e alcança grandes distâncias a partir do ponto de injeção, o que é uma vantagem visto que um número menor de injeçoes do oxidante é necessário para remediar uma área (HULING, 2006). Assim que o radical sulfato é gerado, a partir da ativação química ou térmica do persulfato, ele pode propagar uma série de reações envolvendo a formação de outras espécies ativas, particularmente o radical hidroxila, que é a espécie oxidante predominante em meio alcalino. O pentaclorofenol é um contaminante de subsuperfície comumente encontrado em áreas de tratamento de dormentes de madeira e em industrias que fabricam inseticidas, desta forma o estudo de métodos de degradação deste composto é necessário. Neste trabalho estudou-se o efeito do pH, da presença de Fe2+ e Cu2+ e da concentração de persulfato na degradação de pentaclorofenol.
Material e métodos
Estudo da degradação de pentaclorofenol (PCP) A degradação de PCP foi realizada em erlenmeyers âmbar de 250 mL contendo 50 mL de PCP 50 uM onde foram adicionados os metais estudados (CuSO4 ou FeSO4) e persulfato de sódio para disparar a reação. Para avaliar o efeito do pH usou-se adicionar NaH2PO4 a solução de 50 uM de PCP de modo a produzir um tampão fosfato 10 mM nos pHs 5, 7 ou 9, de acordo com o experimento Os frascos foram colocados em um shaker a 20 °C e agitação de 100 rpm. Determinação de PCP por cromatografia líquida de alta eficiência (HPLC) As condições utilizadas foram: coluna C18 de 12 cm, fase móvel composta por 75% de metanol e 25% de ácido acético a 1%, uma vazao de 0,5 mL/min com 50 µL de injeção.
Resultado e discussão
Vários parâmetros, como concentração de persulfato, pH e presença de íons ferro
e cobre, foram avaliados durante a degradação de PCP por persulfato a 20°C. Na
figura 1 pode-se verificar que o aumento de persulfato para 10 mM em pH 7
propiciou a degradação de 97% de PCP em 12 dias de reação versus 55% e 15% para
5 mM e 1 mM, respectivamente. Embora a velocidade de reação seja lenta a esta
temperatura, este tempo de 12 dias pode bem ser aplicado ao campo uma vez que a
água sbterrânea e os contaminantes nela dissolvidos se locomovem a velocidades
de cm/ ano (dependendo do contaminante e do solo).
Na figura 1B verifica-se o efeito do pH na degradação de PCP, porém, ao
contrário do que relata a literatura, nenhuma diferença foi observada ao se
acidificar ou basificar o meio. Como a faixa de pH não foi muito extensa, já que
as águas subterrâneas apresentam geralmente pH entre 5 e 9, é possível que o
efeito da catálise alcalina só seja observado em pHs mais elevados.
Na figura 1C é possível observar o efeito da presença dos íons Fe2+ e Cu2+ em pH
7. Enquanto o Fe2+ praticamente não alterou a velocidade de degradação de PCP, a
presença de Cu2+ aumentou de 60% para 75% a degradação de PCP em 14 dias.
Esperava-se que o Fe2+ também fosse capaz de catalisar a reação, porém em pH tão
elevado quanto 7 é muito provável que o íon ferroso não esteja mais em solução,
o que explica o resultado.
Embora o pH não altere a reação na ausência de metais, esta é alterada tanto na
presença Fe2+ quanto na de Cu2+, como visto na figura 1D. Para Cu2+ a degradação
em 12 dias é de 95% em pH 5, 90% em pH 9 e 64% em pH 7. Já para Fe2+ a
degradação segue a ordem: pH 5 < pH 7 < pH 9.
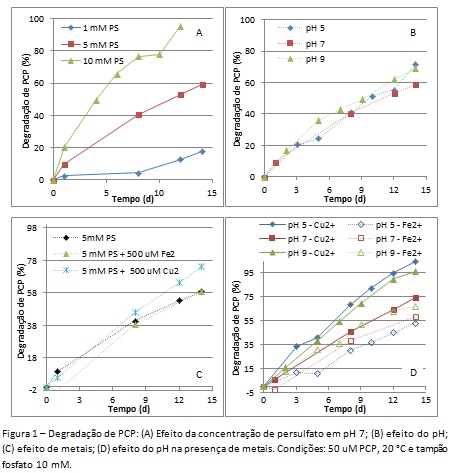
Efeito de diversos parâmetros na degradação de PCP
Conclusões
Dos resultados mostrados pode-se concluir que: - o aumento da concentração de persulfato aumenta a velocidade de degradação do PCP - na ausência de metais a alteração do pH do meio não causa alteração na cinética de degradação - a presença de Cu2+ aumenta a velocidade de degradação de PCP em todos os pHs testados, no entanto o mesmo não acontece com o Fe2+ - o efeito do pH do meio é diferente pra cada metal, ocorrendo a maior degradação em pH 9 para Fe2+ e pH 5 para Cu2+
Agradecimentos
Ao CNPq pela bolsa concedida.
Referências
- Huling, S. G. e Pivetz, B, E.; In-Situ Chemical Oxidation, Engineering Issue - EPA, 2006, 600-R-06-072
- Rastogi, A., Al-Abedb, S.R. e Dionysiou, D. D., Effect of inorganic, synthetic and naturally occurring chelating agents on Fe(II) mediated advanced oxidation of chlorophenols, Water Res., 2009, 43, 684 – 694
- Zhao, J., Zhang, Y., Quan, X. e Chen, S.,Enhanced oxidation of 4-chlorophenol using sulfate radicals generated from zero-valent iron and peroxydisulfate at ambient temperature, Sep. Pur. Techn., 2010, 71, 302–307.










