ISBN 978-85-85905-10-1
Área
Físico-Química
Autores
Silva, A.F.A. (UEMA) ; Sousa, I.P. (UEMA) ; Ericeira, E.R. (UEMA) ; Costa, M.C.P. (UEMA)
Resumo
O presente trabalho é parte integrante de um estudo experimental que foi ministrado durante a disciplina Estudo dos Gases e Termodinâmica no Curso de Licenciatura em Química da Universidade Estadual do Maranhão (UEMA), e possui como objetivo principal confeccionar um protótipo (sistema termodinâmico) que possibilite a obtenção de dados numéricos de p e T a partir da reação do ácido clorídrico com magnésio metálico. Para a confecção do dispositivo, utilizaram-se materiais de baixo custo e fácil aquisição. O mesmo consiste em reproduzir as condições teóricas ideais e favoráveis, que comprovem experimentalmente a veracidade da equação de Charles, tornando-se uma ferramenta útil em termos didático e pedagógico.
Palavras chaves
Dados de p e T; Construção de protótipo; Lei de Charles
Introdução
O estado gasoso tem grande importância teórica e prática. Na pratica, os gases são importantes na vida de todos os seres vivos, assim como na indústria e transportes. Do ponto de vista teórico, podemos dizer que o entendimento do papel dos gases é muito importante para a compreensão das reações químicas (Feltre, 2004).O conhecimento dos estudos dos gases e de suas propriedades é de grande importância nas reações químicas, uma vez que estes estão sempre presentes no nosso dia-dia. De maneira simplificada, podemos dizer que o estudo envolvendo as constantes físicas de uma massa gasosa nos possibilita de maneira lógica, absorver os conceitos e deduções empregados no seu estudo (Mahan & Myers 2003). Segundo Atkins & Paula (2008), a relação entre a pressão e a temperatura, a volume constante, é expressa pela Lei de Charles: “A volume constante, a pressão exercida por determinada massa de gás é proporcional à sua temperatura absoluta”. O presente trabalho possui como objetivo principal confeccionar um protótipo (sistema termodinâmico) que possibilite a obtenção de dados numéricos de p e T a partir da reação do ácido clorídrico com magnésio metálico, visando à comprovação experimental da Lei de Charles para um gás ideal.
Material e métodos
A confecção do protótipo (Figura 1) foi realizada seguindo os passos: Acoplou-se à extremidade superior de um frasco comercial do tipo rosqueável com três voltas, uma junta de encanamento de PVC, com três saídas, uma superior e duas laterais, uma para o termômetro e outra para o manômetro, ambas isolados com cortiças de borracha. As etapas seguintes consistiram em isolar o frasco interno do meio externo: realizadas as conexões, as roscas internas e externas dos frascos foram vedadas com cola de vedação e reforçadas com cola adesiva á base de cianoacrilato para a garantia de não vazamento de gás e uma maior eficiência nos resultados. As vedações posteriores feitas com uso da bomba à vácuo, reforçaram ainda mais o isolamento do meio reacional (frasco interno) com o meio externo. Após construído o protótipo, prepararam-se 50 mL de solução HCl a 2,4 M, em seguida pesou-se 1g de Mg metálico em raspas. Transferiu- se a solução de HCl para o frasco interno do protótipo (Figura 1) e efetuaram–se as conexões do mesmo com a bomba a vácuo afim de reproduzir as condições ideais da reação. Em seguida transferiu-se para dentro do protótipo o metal Magnésio em raspas. No momento em que se encontraram ácido e metal, iniciou- se a reação com intensa produção de gás hidrogênio dentro do protótipo.
Resultado e discussão
A partir dos resultados experimentais obtidos entre a reação do metal magnésio com o ácido clorídrico, foi-se possível observar a produção do gás hidrogênio em um sistema fechado, e estabelecer com auxílio de termômetro e manômetro dados referentes à temperatura e pressão (a volume constante). Os valores registrados pelo sistema demonstraram com clareza, a viabilidade da obtenção das medidas de temperatura e pressão para a produção do gás hidrogênio com a utilização de um método alternativo, possibilitando a alunos do ensino médio a compreensão da relação teoria e prática, bem como de conceitos físico-químicos relacionados ao estudo dos gases. Contudo falhas observadas durante a execução do experimento contribuíram para um déficit no rendimento das medidas de pressão do gás hidrogênio produzido. Neste caso podemos destacar perda de gás nos cinco primeiros segundos de reação do magnésio com o ácido clorídrico, pois a reação acontece instantaneamente ao contato entre esses dois reagentes, acarretando perda de matéria e reduzindo a concentração de gás hidrogênio formado no sistema.

Imagem do protótipo utilizado na realização do experimento
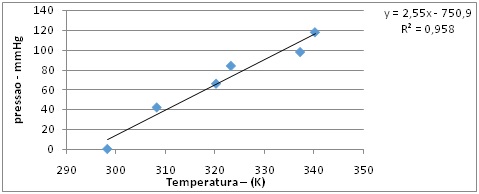
Valores de variáveis obtidos durante o experimento utilizando o metal Mg, medindo a pressão e a temperatura na escala absoluta Kelvin.
Conclusões
Podemos observar no gráfico a proporcionalidade de dados de temperatura e pressão no estudo do gás hidrogênio liberado a partir da reação do ácido clorídrico (HCl) com o metal Mg utilizando um método alternativo bem sucedido, justificando assim que a relação da temperatura pela pressão exercida por uma determinada massa gasosa, aumenta à medida que aumenta também a temperatura, ou seja,a razão entre a temperatura e a pressão é sempre constante a um volume fixo, comprovando assim que, p/T , Lei de Charles.
Agradecimentos
A Universidade Estadual do Maranhão, e a professora Dra Maria Célia Pires Costa pelo incentivo.
Referências
• ATKINS, Peter; PAULA, Julio de. Físico-Química. Vol. 1, 8a Edição. Rio de Janeiro: LTC, 2008.
• FELTRE, 1928- Química / Ricardo Feltre. – 6. Ed. – São Paulo: Moderna, 2004
• MAHAN, Bruce M / Química: um curso universitário – 2003 “tradução da 4° ed. Americana”










