ISBN 978-85-85905-10-1
Área
Materiais
Autores
Fonseca, B.T. (UFRJ) ; Ribeiro, E.S. (UFRJ) ; D'elia, E. (UFRJ)
Resumo
O óxido misto SiO2/TiO2/Nb2O5 foi sintetizado pelo método sol-gel em duas composições, sendo estas 60/10/30 e 60/20/20 respectivamente, percentuais em massa. As caracterizações foram feitas por espectroscopia no infravermelho (IV), difração de raios x (DRX) e microscopia eletrônica de varredura (MEV) acoplada com espectroscopia de energia dispersiva (EDS), fluorescência de raios-x por dispersão em comprimento de onda (WDXRF), área superficial específica (BET), volume de poros, diâmetro médio de poros e análise termogravimétrica (TGA). Na voltametria cíclica (CV) comparou-se o padrão eletroquímico do material frente aos padrões, mostrando que o mesmo pode ser utilizado para futuras aplicações em eletrodos quimicamente modificados (EQMs)
Palavras chaves
processo sol-gel; SiTiNb; sílica-titânia-nióbia
Introdução
A preparação deste óxido misto visa unir as características individuais dos óxidos SiO2, TiO2 e Nb2O5, para se obter um material homogêneo, poroso e com uma maior resistência mecânica e química. Devidos as suas características ácidas estes óxidos possuem aplicações diversas quais sejam: no desenvolvimento de eletrodos quimicamente modificados (EQMs), materiais adsorventes de íons metálicos e corantes em solução, catálise heterogênea, etc (Hench, 1990; Tarley, 2010). Desta forma, o presente trabalho tem como objetivo principal a síntese e caracterização estrutural e eletroquímica do óxido misto, SiO2/TiO2/Nb2O5 obtido pelo processo sol-gel. Espera-se obter um material homogêneo, poroso e com uma maior resistência mecânica e química em relação aos óxidos metálicos isolados (Brinker, 1990; Silva, 1996).
Material e métodos
Os materiais foram preparados nas proporções de 60/10/30 (SiTiNb-A) e 60/20/20 (SiTiNb-B), percentuais em massa, de acordo com o seguinte procedimento: Em um balão a 70°C adicionou-se tetraetilortosilicato, etanol e uma solução de HCl, agitando por 3hs. Em seguida adicionou-se butóxido de titânio pré-dissolvido em etanol, seguido de uma solução de HCl e deixou-se agitar por 1h. Posteriormente, adicionou-se NbCl5, pré-dissolvido em etanol, e deixou-se agitar até o início da formação do gel. A mistura foi transferida para um béquer e seca por 4hs em estufa a 80°C. O material foi triturado e o solvente evaporado a 80°C a vácuo por cerca de 6hs, obtendo-se um gel seco. A lavagem foi feita em extrator soxhlet com etanol, seguida de lavagem com solução de HNO3, água deionizada e etanol. Finalmente, o sólido foi seco a 80°C a vácuo por cerca de 6h. Os espectros de FTIR foram obtidos usando um espectrofotômetro NICOLET Magna-IR 760 e os difratogramas utilizando um difratômetro de raios-X da Rigaku, modelo Ultima IV. A porcentagem em massa dos óxidos foi determinada com um equipamento de fluorescência de raios-X por dispersão em comprimento de onda (WDXRF) da Bruker, modelo S4. A morfologia dos materiais foi analisada utilizando-se MEV acoplado com EDS no equipamento FEI Magellan 400 XHR Scanning Electron Microscope. A área superficial específica, volume de poro e diâmetro médio de poro foram obtidos utilizando o equipamento Quantachrome modelo Nova 1200e. As análises de TGA foram feitas utilizando-se um aparelho de análise térmica DTG-60 da Shimadzu. A caracterização eletroquímica dos materiais foi realizada utilizando um eletrodo de pasta de C e na coleta dos dados foi utilizado um potenciostato/galvanostato AUTOLAB PGSTAT 128N.
Resultado e discussão
O IV apresenta as bandas: 3450cm-1 estiramento O−H;
1630cm-1 deformação O-H; 1300-1000cm-1
estiramento assimétrico Si−O-Si; 960cm-1 estiramento Si-OH ou Si
−O−Nb; 800cm-1 estiramento simétrico Si−O−Si; 600-
550cm-1 deformação Si-OH e estiramento Nb−O−Nb;
470cm-1 deformação Si-O-Si. O IV é similar ao obtido por Aronne,
e indica que a rede de Si é pouco perturbada pela adição de Ti e Nb,
sugerindo inclusão por meio de dispersão na rede (Nakamoto, 1986;
Aronne, 2007; Baltakys, 2007). Os DRX mostraram que os materiais possuem
baixa cristalinidade e a FRX mostrou valores próximos ao teórico.
No MEV (Fig.1), ambos os materiais não apresentam uma forma definida e pelo
EDS, o mapeamento dos átomos de Si, Ti, Nb e O mostra que estes se
apresentam homogeneamente dispersos não havendo segregação de fases.
A área superficial de SiTiNb-A (435m2/g) e SiTiNb-B
(344m2/g) mostra a influência da quantidade do óxido de nióbio. O
volume de poros SiTiNb-A (0,24cm3/g) e SiTiNb-B
(0,19cm3/g) e o diâmetro médio de poros SiTiNb-A (10,9Å) e
SiTiNb-B (10,9Å) mostraram que os materiais são microporosos (Teixeira,
2001).
As curvas de TGA e DTA mostram dois eventos térmicos: SiTiNb-A, até 100°C,
endotérmico com perda de massa de 21% (dessorção de água); de 100-300°C
perda de 0,1% (água estrutural). Após essa temperatura, endotérmico com
perda de 7,8% (matéria orgânica aderida ao material), totalizando 28%.
SiTiNb-B tem um comportamento similar, até 100°C perda de massa de 16%;
entre 100-300°C perda de 0,7% e após 300°C perda de 7,4%, totalizando 24%.
As voltametrias de ambos os materiais mostraram picos de oxidação e
redução que podem ser associados aos padrões.

Microscopias eletrônicas e espectroscopia de energia dispersiva das amostras SiTiNb-A e SiTiNb-B
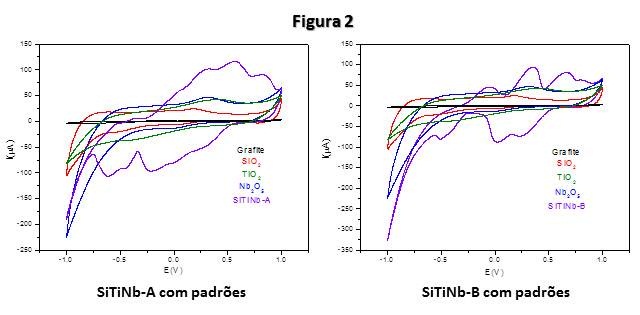
Voltametrias cíclicas dos materiais SiTiNb-A e SiTiNb-B com os padrões dos óxidos puros
Conclusões
Os óxidos mistos SiAlSb-A e SiAlSb-B foram sintetizados pelo processo sol-gel e caracterizados por diferentes técnicas. A síntese se mostrou reprodutível e efeciente, levando a materiais com excelentes características para futura utilização em EQMs tais como: dispersão homogênea dos óxidos de titânio e nióbio na matriz de sílica e alta área superficial específica; características estas fundamentais para que se obter uma boa capacidade adsortiva de espécies eletroativas e íons metálicos em solução. As Aplicações como sensor na imobilização das espécies eletroativas mostram-se promissoras.
Agradecimentos
Os autores agradecem ao CNPq e a FAPERJ pelo apoio financeiro e ao INMETRO pelas análises de MEV, EDS e WDXRF.
Referências
Aronne, A.; Marenna, E.; Califano, V.; Fanelli, E.; Pernice, P.; Trifuoggi, M.; Vergara, A.; J. of Sol-Gel Science and Technology, 43 (2007) 193.
Baltakys, K.; Jauberthie, R.; Siauciunas, R; Kaminskas R.; Materials Science-Poland, 25, 2007, 663.
Brinker, C.J.; Scherer, G.W.; In: Sol-Gel Science: The Physics and Chemistry of Sol-Gel Processing, Academic Press, San Diego, 1990.
Hench, L.L.; West, J.K.; Chemical Reviews 90 (1990) 33.
Nakamoto, K. “Infrared and Raman Spectra of Inorganic and Coodination Compounds”, Wiley, Wisconsin, 1986.
Silva, L.R.D.; Gushiken, Y.; Journal of Colloids Surfaces B: Biointerfaces, 6 (1996) 309.
Tarley, C.R.T.; Ávilla, T.C.; Segatelli, M.G.; Lima, G.F.; Peregrino, G.S.; Scheeren, C.W.; Dias, S.L.P.; Ribeiro, E.S.; Journal of the Brazilian Chemical Society 21 (2010) 1106.
Teixeira, V. G.; Coutinho, F.M.B.; Gomes, A.S.; Quimica Nova, 24 6 (2001) 808.










