Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Ensino de Química
TÍTULO: ELETRODOS DE GRAFITE DE BAIXO CUSTO PARA ESTUDOS EM ELETROANALÍTICA: UMA PROPOSTA DIDÁTICA PARA O ENSINO
AUTORES: Chaves de Moraes, T.D. (UESPI) ; Brandão Lima, A.E. (UESPI) ; Silva Costa, A.M. (UESPI) ; da Silva Santos, R. (UESPI)
RESUMO: A falta de materiais básicos em laboratórios de química muitas vezes limita a
fixação de conceitos importantes dos conteúdos abordados nos cursos de
graduação.Dentre estes materiais destacamos os eletrodos para estudos
eletroquímicos.Visando contribuir com uma alternativa para superar esta
dificuldade propomos uma metodologia simples para o preparo de eletrodos de
grafite de baixo custo e investigamos sua resposta eletroquímica para
determinação de ácido ascórbico.Estudos de voltametria linear mostraram que os
eletrodos apresentam boa resposta de corrente para presença do ácido em
quantidade relativamente baixa.Estes estudos podem ser realizados na maioria dos
laboratórios de graduação,que possuem equipamentos básicos de eletroquímica;tais
estudos são fundamentais na fixação de conceitos.
PALAVRAS CHAVES: Ácido ascórbico; Voltametria; Eletrodos de grafite
INTRODUÇÃO: As voltametrias compreendem um conjunto de técnicas abordadas nos cursos de
graduação em química de muitas instituições de ensino superior.De modo geral
estas técnicas baseiam-se em fenômenos que ocorrem na interface entre a
superfície de um eletrodo de trabalho e uma camada de solução adjacente a essa
superfície.A partir de valores de corrente e potencial é possível obter-se
informações sobre o analito investigado.[1]Nos estudos voltamétricos, os
eletrodos merecem destaque,pois grande parte dos resultados eletroquímicos
dependem da resposta deste eletrodos,que incluem sensibilidade e seletividade.
Em voltametrias,os eletrodos são geralmente construídos de materiais inertes,
dentre os quais destacam-se os metais ouro e platina.Outros eletrodos também
muito investigados são os de filme de mercúrio e carbono vítreo.[2]De modo
geral,estes eletrodos devem apresentar excelente estabilidade na faixa de
potencial investigado.Contudo,os eletrodos comerciais possuem custo
relativamente elevado e,portanto,não são largamente utilizados em estudos nos
laboratórios de graduação,durante as aulas.Visando fornecer uma alternativa para
realização de estudos voltamétricos nas aulas de graduação, investigamos a
resposta eletroquímica de eletrodos de baixo custo construídos a partir do
bastão de grafite removido de pilha comum (pilha seca).
Para investigar a resposta do eletrodo construído a partir dos eletrodos de
grafite,investigamos sua reposta eletroquímica para determinação da presença de
ácido ascórbico.O ácido ascórbico,popularmente conhecido como vitamina C,é uma
molécula utilizada na hidroxilação de diversas reações químicas celulares.[3]É
hidrossolúvel e pode ser facilmente adquirido em farmácias,na forma de
comprimidos efervescentes,ou em sucos de frutas cítricas.
MATERIAL E MÉTODOS: Para construção dos eletrodos de grafite uma pinha comum foi cuidadosamente
aberta com o auxílio de um alicate;um bastão de grafite de aproximadamente 3 cm
foi removido.O bastão foi dividido em três partes,uma delas foi lixada para
obtenção de grafite em pó.Este pó foi misturado a uma resina tipo Epóxi
(encontrada no comércio)numa proporção de 70 %(grafite/resina).O bastão de
grafite foi colocado em um tubo plástico(obtido de caneta esferográfica) e
fixado com a mistura grafite/resina Epoxi.A mistura também foi utilizada para
unir um fio de cobre ao bastão de grafite.Após a completa cura da resina, os
eletrodos foram polidos com lixas 120, 400, 600 e 1200,respectivamente(para as
duas ultimas lixas utilizou-se água durante o procedimento).Inicialmente
preparou-se uma solução tampão de ácido acético/acetato de sódio (pH 4,7),
dissolvendo-se 20,5 g de CH3COONa e 15,0 mL de CH3COOH em um balão de 500 mL.
Para o preparo da solução de ácido ascórbico, triturou-se um comprimido do
medicamento de vitamina C em água e diluiu-se para 100 mL.De acordo com o
fabricante, cada comprimido contém 500 mg de vitamina C.
Em uma célula adicionou-se 30 mL da solução tampão e montou-se o sistema com
três eletrodos, sendo o eletrodo de grafite como eletrodo de trabalho e contra-
eletrodo e um eletrodo de Ag/AgCl com referência. Os estudos foram realizados em
um potenciostato/galvanostato, modelo PGSTAT302N da Metrohm. A primeira medida
de voltametria linear foi realizada na janela de potencial de 0,3 a 0,9 V sem a
presença do ácido ascórbico(branco),em velocidade de varredura de 20 mV/s.Em
seguida,realizou-se varreduras com adições sucessivas de 100, 200, 300, 400 e
500 µL da solução medicamento.Para avaliar o comportamento redox do
medicamento,realizou-se também uma voltametria cíclica.
RESULTADOS E DISCUSSÃO: A Figura 1 apresenta as curvas de voltametria linear obtidas para diferentes
concentrações do medicamento.Quando comparada ao braço, as medidas feitas na
presença do ácido ascórbico apresentou um sinal de oxidação em potencial menor
(ca. 0,7 V). Observa-se ainda que as curvas de voltametria linear apresentam um
progressivo aumento dos valores de corrente com o aumento da quantidade de ácido
adicionado.
Figura 1. Curvas de voltametria linear obtidas com diferentes quantidades de
ácido ascórbico em meio tamponado, utilizando eletrodos de grafite.
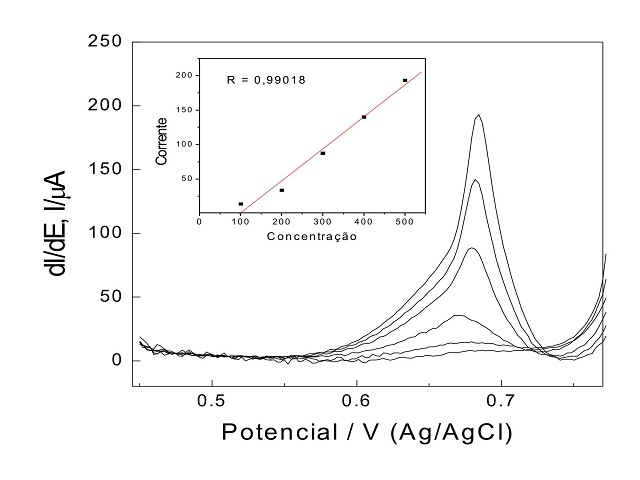
Curvas obtidas a partir da derivada dos voltamogramas apresentados na Figura 1
foram utilizadas para avaliar a linearidade do sinal de corrente com o aumento
da concentração do analito. As curvas derivas estão apresentadas na Figura 2.
Figura 2. Curvas obtidas a partir da primeira derivada dos voltamogramas
lineares registrados para o ácido ascórbico em meio tamponado, utilizando
eletrodos de grafite de baixo custo.
A Figura 2 mostra que existe uma boa linearidade no aumento dos valores de
correntes com o aumento da concentração do ácido ascórbico na célula
eletroquímica. A curva dos valores de corrente em função da quantidade de ácido
ascórbico (apresentada insert) mostrou um coeficiente de correlação de
aproximadamente 0,9902.
Os estudos de voltametria cíclica, realizadas para o ácido também foram
realizados. Estes estudos mostram voltamogramas com um único sinal de oxidação e
de comportamento irreversível.
Figura 1

Curvas de voltametria linear obtidas com diferentes
quantidades de ácido ascórbico em meio tamponado,
utilizando eletrodos de grafite.
Figura 2
Curvas obtidas a partir da primeira derivada dos
voltamogramas lineares registrados para o ácido em
meio tamponado,utilizando eletrodos de baixo custo
CONCLUSÕES: Os eletrodos preparados a partir de grafite obtido em pilhas comum apresentaram
uma boa resposta eletroquímica para os estudos realizados com o ácido
ascórbico.Com o aumento da concentração,os voltamogramas lineares apresentaram um
aumento progressivo para a corrente associada a oxidação do medicamento.Além da
técnica investigada,os eletrodos podem ainda ser utilizados em outras técnicas
eletroanalíticas incluindo as de voltametria cíclica,pulso diferencial e onda
quadrada.Estes estudos mostram que a montagem deste tipo de eletrodos de baixo
custo oferece uma boa alternativa para os alunos.
AGRADECIMENTOS: Agradecemos à coordenação do Laboratório GERATEC,por disponibilizar o
espaço físico,equipamentos e reagentes.
Ao querido Breno Oliveira pela ajuda.
REFERÊNCIAS BIBLIOGRÁFICA: [1] SKOOG, D. A. et al. “Fundamentos da Química Analítica”. 1ª edição. Tradução de Grassi, M. T. São Paulo: Pioneiras Thompson Learning, 2006.
[2] Aleixo, L.M., Sitton, M. e Ribeiro, F.A.L., "Estudo polarográfico sobre a determinação de Fe(III) utilizando-se a técnica da polarografia de pulso diferencial", 4ª edição. Química Nova, 2001.
[3] BRUICE, Paula Yurkanis. "Química Orgânica". 4ª edição. São Paulo: Pearson
Prentice Hall, 2006.
