Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Ambiental
TÍTULO: ESTUDO DA CINÉTICA DE ADSORÇÃO DO ÍON AMÔNIO, UTILIZANDO RESINAS POLIMÉRICAS DE TROCA IÔNICA.
AUTORES: Marques, M.R.C. (UERJ) ; Bahe, J.M.C.F. (UERJ)
RESUMO: Lixiviados de aterros sanitários apresentam em sua composição amônia em
concentrações elevadas, dificultando o tratamento biológico. Troca-iônica é um
processo de adsorção de íons em soluções aquosas. No presente estudo, a sorção
foi investigada através da resina comercial Amberlyst 15 wet em um sistema de
batelada, utilizando um efluente simulado de cloreto de amônio (NH4Cl) em três
tipos de concentração (50, 100 e 200 mg/dm3). Os resultados apontaram um tempo de
contato em torno de 20 min para a resina entrar em equilíbrio e uma capacidade de
adsorção de em torno de 60 mg/g. Diferentes modelos cinéticos foram aplicados
pseudo-primeira ordem, pseudo-segunda ordem, difusão intrapartícula, Elovich e o
modelo cinético de difusão externa e os resultados discutidos.
PALAVRAS CHAVES: Lixiviado de aterro; Cinética de adsorção; Amônia
INTRODUÇÃO: Na fase metanogênica, o lixiviado de aterro sanitário, geralmente, apresenta
teores de amônia em torno de 2.000 mg/dm3, dificultando o tratamento, visto que
um grama de nitrogênio amoniacal consome 4,6 gramas de oxigênio, sendo
necessário o aumento do consumo de energia elétrica para a introdução do
oxigênio nos reatores biológicos. O stripping é um tratamento que antecede o
tratamento biológico e visa diminuir a quantidade de amônia antes da etapa dos
reatores biológicos, convertendo o íon amônio em amônia e lançando-a na
atmosfera, o que torna o ambiente das estações insalubre (JORDÃO & PESSÔA,
2005). Outro tipo de pré-tratamento de lixiviado é a evaporação que reduz o
volume a tratar e lança os vapores da evaporação na atmosfera; diminuindo a
carga de efluente hídrico; porém as emissões na atmosfera indicam forte presença
de amônia, o que pode causar impactos negativos em torno do aterro (BAHÉ et al.,
2008). O CONAMA 436 define que a amônia atmosférica deva ser reduzida em 98%. As
resinas de troca-iônica são polímeros insolúveis que contêm íons fracamente
ligados e são capazes de trocar esses íons através de soluções que contém íons
de interesse através do contato. A adsorção depende principalmente das
propriedades do poluente em questão, da estrutura e química da superfície do
adsorvente (AGUIAR & NOVAES, 2002). A adsorção do íon amônio através de resinas
poliméricas tem sido investigada por alguns pesquisadores obtendo bons
resultados (VIGNOLI, 2007; JORGENSEN & WEATHERLEY, 2003). O objetivo principal
deste estudo é conhecer através da modelagem cinética como é realizado o
processo de sorção dos íons amônio pela resina visando o seu uso na remoção de
amônia de lixiviado.
MATERIAL E MÉTODOS: A amônia foi quantificada através do eletrodo de íon seletivo segundo o Standard
Methods. A cinética de adsorção é governada por dois fatores principais: teor de
divinilbenzeno (DVB), que determina a porosidade das resinas poliméricas, e
mobilidade das espécies iônicas no interior da estrutura das resinas. Por outro
lado, o tamanho dos íons que estão sendo trocados também é um fator importante a
considerar no estudo da cinética e da capacidade de troca destas reações (DOYLE
et al., 2002). O grupamento iônico predominante das resinas fortemente ácidas
catiônicas) é grupamento sulfônico (R-SO3), podendo apresentar-se na forma ácida
R-SO3H) ou na forma de sal (R-SO3Na). Quando na forma sódica ou hidrogenada, as
resinas fortemente ácidas estão altamente dissociadas e os íons estão
disponíveis para serem trocados em qualquer faixa de pH (LEE et al., 2006).
Segundo a série liotrópica de Hofmeister (1888) o potencial de troca do íon
hidrogênio é maior em relação ao íon sódio e menor em relação ao íon amônio,
além da macroporosidade permitir maiores sítios de troca. A resina comercial
Amberlyst 15 wet possui as seguintes características: catiônica, fortemente
ácida, sulfônica na forma de hidrogênio, estrutura macroporosa (SO3H). O estudo
do tempo de contato entre a resina e o íon amônio foi realizado através de 50
cm3 de NH4Cl em três tipos de concentração inicial 50, 100 e 200 mg/dm3, a 25
±1◦C, utilizando 0,05 g da resina sob agitação de 250 rpm, nos seguintes tempos
de contato: 5, 10, 15, 20, 30, 60, 120, 180 e 200 minutos e, a partir dos
resultados obtidos foi possível avaliar a capacidade de sorção da resina em
função do tempo e realizar a modelagem cinética com o intuito de investigar o
mecanismo de adsorção.
RESULTADOS E DISCUSSÃO: A quantidade de íons adsorvidos em função do tempo pela resina foi calculada e a
solução de 100 mg/dm3 apresentou a melhor relação entre concentração, quantidade
de resina e tempo de contato (20 min), indicando que a maior capacidade de
sorção (62,60 mg de íon amônio por grama de resina). O Mecanismo de sorção foi
investigado através da modelagem cinética. A cinética de pseudo-primeira ordem é
apresentada pela equação de Lagergren e de acordo com esse modelo apenas as
características da resina influenciam na cinética de adsorção. Os coeficientes
de correlação (r2) apontaram para um mau ajuste desse modelo. A cinética de
pseudo-segunda ordem tipo 1 relaciona à quantidade de íons na superfície da
resina e a quantidade de íons adsorvidos no equilíbrio e os resultados
apresentaram um bom ajuste, com r2=0,99 e a menor diferença entre qe modelo e qe
experimental entre todos os modelos apresentados, indicando que a sorção depende
tanto das características da resina quanto das características da solução e,
portanto, está de acordo com o modelo cinético de pseudo-segunda ordem (DIZGE,
2009). A equação de Elovich estuda o processo de quimissorção. Os resultados
indicaram r2=0,88 e com a diferença apresentada entre o qe modelo e o qe
experimental foi possível afirmar que a adsorção em estudo obedece a este modelo
em ordem decrescente de importância. O modelo de difusão intrapartícula é um
processo no qual o adsorbato é transportado da solução para os poros no interior
da superfície e os resultados indicaram que não foi à etapa controladora porque
a reta obtida não passou na origem (HO, 2006). A difusão externa não é
importante neste mecanismo de sorção, pois os coeficientes de correlação
apresentaram valores r2<0,99 (KARADAG et al.,2006).
Figura 1 - Capacidade de Adsorção em função do tempo

Ilustra a solvatação dos íons pela de 50 mg/dm3; a
rápida saturação pela de 200 mg/dm3 e a eficiência
de remoção pela de 100 mg/dm3.
Figura 2 - Modelo Cinético de Pseudo-Segunda Ordem Tipo I
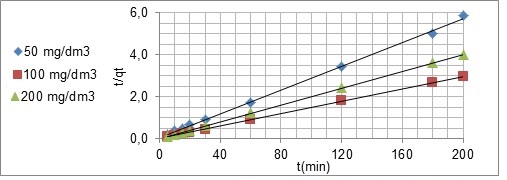
Ilustra que a sorção do íon amônio pela resina
Amberlyst 15 wet depende tanto das características
da resina quanto das características da solução.
CONCLUSÕES: A modelagem cinética demonstrou que o processo de adsorção do íon amônio pela
resina Amberlyst 15 wet segue o modelo de pseudo-segunda ordem tipo 1 e isso
significa que o processo de adsorção depende tanto das características da resina
quanto das características da solução. A resina Amberlyst 15 wet mostrou-se
eficiente na remoção do íon amônio, e dentre as concentrações estudadas a melhor
relação encontrada foi concentração inicial (100 mg/dm3), tempo de equilíbrio(20
min) e quantidade de resina (0,05)obtendo uma eficiência de remoção do íon amônio
em torno de 60% por grama de resina.
AGRADECIMENTOS: Á Dow Brasil Sudeste Industrial Ltda pela doação da resina
Amberlyst 15 Wet e ao CNPq que viabilizaram esta pesquisa.
REFERÊNCIAS BIBLIOGRÁFICA: AGUIAR, M. R. M. P.; NOVAES, A.C. 2002. Remoção de metais pesados de efluentes industriais por aluminossilicatos. Química Nova, 25: 6B: 1145-1154. AMERICAN PUBLIC HEALTH ASSOCIATION; AMERICAN WATER WORKS ASSOCIATION; WSTER ENVIRONMENT FEDERATION. 1998. Standard Methods for the Examination of Water and Wastewater. APWA; AWWA; WPCF, 20º edition. BAHÉ, J. M. C. DE F.; FLORENCIO, L.; GAVAZZA, S.; JORDÃO, E. P.; KATO, M. T. 2009. Estudo da eficiência do pré-tratamento de lixiviados de aterro sanitário por evaporação. In Anais do 25º Congresso Brasileiro de Engenharia Sanitária e Ambiental, III-292. CONAMA - Conselho Nacional do Meio Ambiente. Resolução n° 436/11. Estabelece os limites máximos de emissão de poluentes atmosféricos para fontes fixas instaladas. Brasília: IBAMA. DIZGE, N; KESKINLER, B; BARLAS, H. 2009. Sorption of Ni(II) ions from aqueous solution by Lewatit cation-exchange resins. Journal of hazardous materials,167: 915-926. DOYLE, F.M.; DINIZ, C.V.;CIMINELLI,V.S.T. 2002. Effect of pH on the adsorption of selected heavy metals ions from concentrated chloride solutions by the chelating resin Dowex M- 4195. Separation Science and Technology, 37: 14: 3169 – 3185. HO, Y. 2006. Review of second-order models for adsorption systems. Journal of Hazardous Materials, B 136: 681–689. HOFMEISTER, F. 1888. Zur Lehre von der Wirkung der Salze. Zweite Mittheilung. Arch Exp Pathol Pharmakol, 24: 247-260. JORDÃO, E. P.; PESSÔA, C. A. 2005. Tratamento de esgotos domésticos. Rio de Janeiro: 932p. JORGENSEN ,T.C.; WEATHERLEY, L.R. 2003. Ammonia removal from wastewater by ion exchange in the presence of organic contaminants. Water Research. 37: 1723–1728. KARADAG, D.; KOC, Y.; TURAN, M e ARMAGAN, B. 2006. Removal of ammonium ion from áqueos solution using natural Tukish clinoptilolite. Journal of Hazardous Materials, B136: 604-609. LEE, I. H., KUAN, Y.C., CHERN, J.M. 2006. Factorial Experimental Design for Recovering Heavy Metals from Sludge with Ion-Exchange Resin. Journal of Hazardous Materials, 138: 549-559. ROHM AND HASS. São Paulo: Rohm And Haas Química. “Apresenta informações sobre a resina Amberlyst 15 wet”. Disponível em: < http://www.rohmhaas.com/>Acesso em: 09 Mai. 2013. VIGNOLI, C.N. 2007. Avaliação da minimização das emissões de amônia no processo de tratamento de chorume por evaporação. Dissertação de mestrado-Universidade Estadual do Rio de Janeiro. Centro de Tecnologia e Ciências. Instituto de Química,89.
