Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Química Analítica
TÍTULO: DETECÇÃO IMPEDIMÉTRICA DE GLICOPROTEÍNAS PLASMÁTICAS EM PACIENTES INFECTADOS PELO VÍRUS DA DENGUE ATRAVÉS DE CAMADAS LIPÍDICAS AUTOMONTADAS E LECTINA
AUTORES: Luna, D. (UFPE) ; Oliveira, M. (UFPE) ; Nogueira, M. (FAMERP) ; Andrade, C. (UFPE)
RESUMO: A dengue é considerada um problema de saúde pública mundial. Desta forma, o diagnóstico precoce é relevante para o controle da doença. Neste trabalho propomos o desenvolvimento de um biossensor constituído por membranas lipídicas e lectina para a detecção de glicoproteínas presentes no soro de pacientes contaminados pelo vírus da dengue tipo I (DENVI), II (DEVII) e III (DENVIII). Os padrões de resposta foram analisados por voltametria cíclica (VC), espectroscopia de impedância eletroquímica (EIE) e microscopia de força atômica (AFM). Nossos resultados demonstraram que o biossensor foi capaz de reconhecer a presença de glicoglicoproteínas presentes no soro de pacientes contaminados, sendo esta resposta mais expressiva para o sorotipo DENVIII.
PALAVRAS CHAVES: Biossensor; Lectina; Dengue
INTRODUÇÃO: O vírus da dengue (DENV) representa um problema de saúde pública de alta morbidade e mortalidade, com cerca de 40% da população mundial em risco de contrair a doença (WHO, 2009). Os quatro sorotipos existentes do vírus (DENV-I, II, III, IV) podem causar diversos sintomas clínicos que compreende desde um estado febril ao choque hipovolêmico, sendo, portanto, de extrema relevância o desenvolvimento de novos métodos de diagnóstico rápidos e precisos. Biossensores apresentam a vantagem de possibilitar diagnóstico em tempo real de forma específica e com facilidade operacional. A identificação de carboidratos por biossensores tem sido vastamente utilizada na identificação de patologias (ZENG et al., 2012). Em se tratando da doença dengue, sabe-se que em estágios precoces da doença existe um aumento na expressão de glicoproteínas presentes no soro do paciente infectado (XU et al., 2006). Desta forma, biossensores podem obtidos através da imobilização da lectina Concanavalina A (ConA), uma lectina que se liga especificamente a resíduos de glicose e manose, sobre camadas lipídicas automontadas. Lipídios têm sido utilizados em biossensores principalmente por diminuir a interação com espécies eletroatrativas e favorecer a amplificação do sinal de resposta (RAMSDEN, 1998). Além disso, proporcionam um ambiente natural compatível com a imobilização de proteínas impedindo a sua desnaturação. O presente trabalho propõe o desenvolvimento de um biossensor constituído por camadas lipídicas automontadas e ConA para detectar glicoproteínas presentes no soro de pacientes contaminados por dengue através de técnicas eletroquímicas de caracterização voltametria cíclica (VC), espectroscopia de impedância eletroquímica (EIE) e microscopia de força atômica (AFM).
MATERIAL E MÉTODOS: A lectina Concanavalina A, o lipídio 1,2-dipalmitoil-sn-glicero-3-fosfatidilcolina (DPPC) foram obtidos da Sigma Chemical Co. (St. Louis, EUA). Os soros dos pacientes contaminados por dengue cedidos pelo Laboratório de Virologia da Faculdade de Medicina de São José do Rio Preto (FAMERP) e previamente caracterizados utilizando RT-PCR. Tampão fosfato salino (PBS) (pH 7,4) contendo 0,1 M de CaCl2 e 0,1 M de MnCl2 foi utilizado para preparar as soluções de Con A. A água ultrapura foi obtida do sistema de purificação (Millipore-Synergy). Vesículas lipídicas (lipossomas) foram preparadas por hidratação do filme lipídico. Inicialmente, uma solução 1mM de DPPC em clorofórmio/metanol (9:1, v/v) foi submetida a rotaevaporação (25 min a 40±1 °C). O filme lipídico obtido foi então hidratado com 1mL de PBS a 0.2 M (pH 7.4). A suspensão foi mantida em agitação magnética por 40 min. Na obtenção de cada camada constituinte do biossensor, primeiramente 2 μL da suspensão de lipossomas foi adsorvido na superfície do eletrodo de ouro (para se obter a camada automontada dos lipídios) por 15 min e em seguida lavado com água ultrapura para remoção dos lipídios não adsorvidos. Posteriormente, 1mL de ConA (50 μg/mL) foi incubado na camada automontada dos lipídios. Finalmente o eletrodo modificado Au-lipídio-Con A foi exposto por 20 min em 2μL do soro na concentração 1:10 diluído em 10 mM de PBS pH 7.4. Para as medidas eletroquímicas foi utilizado o potenciostato PGSTAT 128N (Autolab, Eco Chemie, The Netherlands) interfaciado com o computador e sonda redox de ferro- ferricianato de potássio 10mM pH 7.4. Os resultados obtidos representam a média de três medidas independentes. As imagens de AFM foram obtidas com o microscópio PicoSPM II (USA).
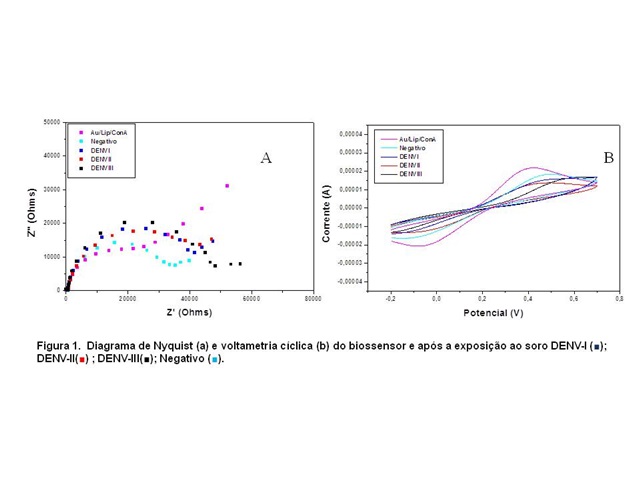
RESULTADOS E DISCUSSÃO: A Fig. 1 representa a caracterização eletroquímica por EIE (Fig. 1A) e VC (Fig. 1B) do sistema sensor e frente a exposição aos soros diluídos (1:10). A presença do soro controle proporcionou um discreto aumento do diâmetro do semicírculo e na variação da resistência a transferência de carga (ΔRCT) de 17,5 kΩ para 24,4 kΩ o que demonstra o reconhecimento de resíduos glicídicos. De fato, existe uma vasta quantidade de glicoproteínas presentes no soro as quais podem ser reconhecidas pela ConA (SPARBIER, 2007). Contudo, a resposta ao soro DENVIII foi considerada mair (ΔRCT = 48,4 kΩ) quando comparada aos soros DENVI (ΔRCT = 32,3 kΩ) e DENVII (ΔRCT = 30,6 kΩ). Desta forma, o DENV III induz maior expressão de glicoproteínas plasmáticas reconhecidas pela ConA. A infecção pelo vírus da dengue provoca uma resposta inflamatória que vai depender de uma variedade de fatores tais como o sorotipo do vírus e as condições imunológicas do hospedeiro (GLUBER,1998; KURANE, 2007). De acordo com a Fig. 1B, podemos observar que após a exposição aos soros observa-se diminuição da corrente dos picos do par redox sendo mais expressivo durante a exposição ao soro contaminado com DENVIII o qual praticamente ocorre desaparecimento das correntes de pico. Isto ocorre devido ao fato de que o complexo glicoproteína-lectina provoca uma camada bloqueadora da transferência de elétrons dificultando a difusão da sonda redox. As análises morfológicas são apresentadas na Fig. 2, o lipídio apresenta distribução heterogênea e com regiões mais aglomeradas (30 nm). A ConA se distribui na região lipídica e apresenta altura de 12nm, confirmando a estrutura tetramérica. A incorporação do DENV ao sistema proporcionou uma alteração no perfil da imagem.

CONCLUSÕES: Foi possível a obtenção de biossensor com alta sensibilidade e especificidade constituído por camada lipídica automontada e lectina para o reconhecimento de glicoproteínas presentes no soro de pacientes contaminados com DENVI, DENII e DEVIII. A presente estratégia de montagem do biossensor é uma promissora alternativa para o diagnóstico da dengue.
AGRADECIMENTOS: FACEPE, CNPq e Rede de Nanobiotecnologia-CAPES.
REFERÊNCIAS BIBLIOGRÁFICA: WHO. 2009. Dengue guidelines for diagnosis, treatment, prevention and control. http://www.who.int/topics/dengue/en/.
ZENG, X.; ANDRADE, C.A.S.; OLIVEIRA, M.D.L., SUN, X.-L. 2012. Carbohydrate-protein interactions and their biosensing applications. Anal. Bioanal. Chem. 402:3161- 3176.
XU, H.; DI, B.; PAN, Y.X.; QIU, L.W.; WANG, Y.D.; HAO, W.; HE, L.J.; YUEN, K.Y.; CHE, X.Y. 2006.Serotype 1-specific monoclonal antibody-based antigen capture immunoassay for detection of circulating nonstructural protein NS1: implications for early diagnosis and serotyping of dengue virus infections. J. Clin. Microbiol. 44: 2872-2878.
RAMSDEN, J.J. 1998. Biomimetic protein immobilization using lipid bilayers, Biosens. Bioelectron. 13:593–598
SPARBIER, K.; ASPERGER, A.; RESEMANN, A.; KESSLER, I.; KOCH, S.; HENZEL, T.; STEIN, G.; VORWER, G,L.; SUCKAU, D.; KOSTRZEWA, M. 2007. Analysis of Glycoproteins in Human Serum by Means of Glycospecific Magnetic Bead Separation and LC-MALDI-TOF/TOF Analysis with Automated Glycopeptide Detection. J. Biomol. Tech. 18:252-258.
GUBLER, D.J. 1998. Dengue and dengue hemorrhagic fever. Clin. Microbiol. Rev. 11:480-496.
KURANE,I. 2007. Dengue hemorrhagic fever with special emphasis on immu-nopathogenesis. Comp. Immunol. Microbiol. Infect. Dis. 30:329-340.
