Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Química Analítica
TÍTULO: DETERMINAÇÃO ESPECTROFLUORIMÉTRICA DE CETOCONAZOL EM AMOSTRAS DE ÁGUAS NATURAIS
AUTORES: Neiva, A.M. (UFGD) ; Vieira, H.J. (UFGD) ; Barros, H.L.B.V. (UFGD)
RESUMO: O presente trabalho propõe o desenvolvimento de um procedimento espectrofluorimétrico para determinação de cetoconazol. A influência do pH foi avaliada, sendo o pH 9,0 o mais adequado no meio estudado. Depois de otimizado, o procedimento apresentou uma relação linear entre a intensidade de emissão e a concentração do cetoconazol no intervalo de 1,0x10- 6 a 8,0x10- 5 mol L- 1 . A aplicação do procedimento proposto foi avaliada na detecção de cetoconazol em amostras de águas, obtendo-se recuperações no intervalo de 89 a 127%.
PALAVRAS CHAVES: Cetoconazol; espectrofluorimetria; águas de superfície
INTRODUÇÃO: O cetoconazol de nome químico cis-1-acetil-4-[4-[[2-(2,4-diclorofenil) -2-(1H-imidazol-lil-metil) 1,3-dioxolan-4-il]metoxi]fenil]piperazina, sintetizado em 1979, foi o primeiro azol a ser administrado oralmente para tratamento de infecções sistêmicas por fungos (PANDEESWARAN et al., 2009). Sua estrutura apresenta dois grupos básicos, a piperazina e o imidazol com valores de pKa de 2,94 e 6,51, respectivamente (ANTONIO, 2007). Seu controle de qualidade, na indústria farmacêutica pode ser realizado por várias técnicas, tais como titulação em meio não aquoso, espectrofluorimetria, eletroforese capilar, cromatografia líquida de alta eficiência, potenciometria, voltametria e polarografia, sendo que algumas delas exigem materiais de alto custo e aparelhagem complexa (SHAMSIPUR et al., 2000). Dessa forma, o desenvolvimento de um procedimento simples e de baixo custo para a determinação de Cetoconazol é de grande interesse. O objetivo deste trabalho foi utilizar a espectroscopia de fluorescência para detecção de Cetoconazol em amostras de água de córregos da cidade de Dourados-MS.
MATERIAL E MÉTODOS: A solução de cetoconazol 1,0x10- 3 mol L- 1 , foi preparada pesando a massa adequada da substância padrão solubilizado o sal em solução HCl 0,1 mol L- 1 . A avaliação do efeito do pH sobre o sinal de fluorescência foi realizado empregando solução tampão de fosfato de potássio monobásico anidro, KH2PO4 1,0 mol L- 1 (Vetec, 99% de pureza). As medidas fluorimétricas foram realizadas no espectrofluorímetro (Cary Eclipse, Varian) equipado com uma lâmpada de xenônio, utilizando-se cubeta de quartzo, com quatro faces polidas, de caminho ótico de 10 mm e volume de 3,5 ml. Para a obtenção dos valores dos comprimentos de onda de emissão e excitação, efetuou-se uma varredura espectral fixando-se o comprimento de onda de excitação em 240 nm e emissão entre 245 a 700 nm. A intensidade de fluorescência das soluções padrões e amostras foram obtidas diluindo-se uma alíquota da solução contendo o analito em balão volumétrico de 10 mL e o volume completado com solução tampão pH 9,0 KH2PO4 1,0 mol L- 1 . Avaliou-se a recuperação de duas amostras de água provenientes de dois córregos da cidade de Dourados-MS, Rego D’água e Água Boa. Estudos de recuperação foram realizados nas duas amostras, adicionando-se quantidades conhecidas dos padrões de cetoconazol, em dois níveis de concentração 2x10- 6 e 4x10- 6 mol L- 1 .
RESULTADOS E DISCUSSÃO: O procedimento proposto baseia-se na propriedade do cetoconazol de sofrer fluorescência quando excitado com radiação eletromagnética na região do ultravioleta. Inicialmente obteve-se o espectro 3D de uma solução de Cetoconazol para verificar os comprimentos de onda de excitação e emissão (Figura 1). Verificou-se que os comprimentos são λex= 240 nm e λem= 375 nm. A influência do pH sobre o sinal analítico foi avaliada entre os pH de 4,0 a 10,0. Verificou-se um aumento da intensidade de emissão com o aumento do pH do meio. Dessa forma, o pH 9,0 foi fixado para os demais procedimentos. Sob as condições otimizadas, o procedimento apresentou uma curva analítica com resposta linear no intervalo de 1,0x10- 6 a 8,0x10- 5 mol L- 1 . Obteve-se para o cetoconazol uma equação de regressão linear de I = 3x107 x[CET] + 4,4602, r = 0,998; onde I é a intensidade de emissão (UA) e [CET] concentração de Cetoconazol em mol L- 1 . O limite de detecção de 4,46x10- 7 mol L- 1 ou 0,24 mg/L foi obtido nas condições otimizadas (3xσ branco/ inclinação da curva analítica). Realizou-se estudo de recuperação do cetoconazol adicionado às amostras de águas em diferentes níveis de concentração, como mostra a Tabela 1, apresentando valores de recuperação na faixa de 89 a 127%. Avaliando-se a recuperação média das amostras de águas fortificadas, observa-se uma influência da matriz da amostra A sobre a determinação de cetoconazol, mas o procedimento apresentou valores aceitáveis de recuperação na amostra B para a faixa de concetração do analito nas amostras analisadas (GONZÁLEZ, 1999 e APVMA, 2004).
Figura 1.

Espectro 3D de uma solução de cetoconazol 1x10-3 mol/L, obtido em solução tampão KH2PO4 0,1 mol/L.
Tabela 1
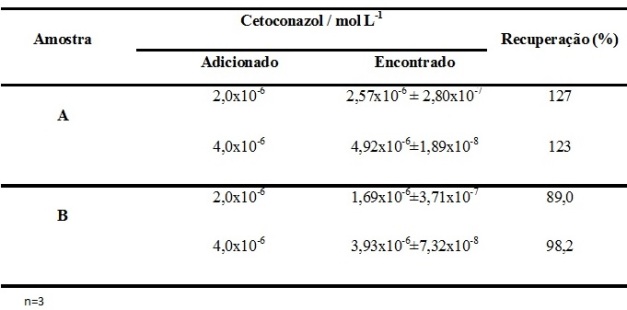
Estudo da recuperação de cetoconazol em amostras de água de córrego
CONCLUSÕES: O procedimento espectrofluorimétrico desenvolvido mostrou-se seletivo e com sensibilidade adequada à determinação de cetoconazol, em amostras de água. É um procedimento fácil, sem a necessidade de preparo das amostras e apresenta-se como um procedimento alternativo aos métodos cromatográficos para determinação desse princípio ativo nas amostras avaliadas.
AGRADECIMENTOS: A CAPES pela bolsa de mestrado, ao Grupo de Óptica Aplicada da UFGD e a UFGD.
REFERÊNCIAS BIBLIOGRÁFICA: ANTONIO, M.E.C.O. 2007. Permeação cutânea in vitro como ferramenta auxiliar para o estudo de formulações semi-sólidas de cetoconazol para aplicações tópicas. Dissertação de Mestrado. Curitiba: UFPR / Departamento de Farmácia. 147 p.
AUSTRALIAN PESTICIDES & VETERINARY MEDICINES AUTHORITY , 2004. Guidelines for the validation of analytical methods for active constituent, agricultural and veterinary chemical products. Acessado em dezembro de 2012. Disponível em: http://www.apvma.gov.au/publications/guidelinesdocsgl_69_analytical_methods.pdf.
GONZÁLEZ, A.G., HERRADOR, M.A., ASUERO, A.G. 1999. Intra-laboratory testing of method accuracy from recovery assays. Talanta, 48:729-736.
PANDEESWARAN, M.; ELANGO, K. P., 2009. Electronic, Raman and FTIR spectral investigations of the charge transfer interactions between ketoconazole and povidone drugs with iodine. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 72:789-795.
SHAMSIPUR, M. e JALALI F. 2000. Preparation of ketoconazole ionselective electrode and its application to pharmaceutical analysis, Analytical Science. 16: 549-552.
