Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Química Analítica
TÍTULO: AVALIAÇÃO DA ESTABILIDADE DO ÓLEO DE NABO FORRAGEIRO (Raphanus sativus L.) FRENTE A ADIÇÃO DO CORANTE SOLVENTE AZUL 35 COMO ADITIVO ALTERNATIVO
AUTORES: Souza, A.C.D. (UFGD) ; Silva, F.S. (UFGD) ; Pimentel, N.B. (UFGD) ; Lima, A. (UFGD) ; Souza, A. (UFGD) ; Muzzi, R. (UFGD) ; Ferreira, V. (UFMS) ; Trindade, M.A.G. (UFGD)
RESUMO: Avaliou-se o desempenho do corante Solvente azul 35 (SA-35) como aditivo
alternativo na estabilização do óleo extraído de nabo forrageiro (Raphanus sativus
L.). Os parâmetros indicativos da degradação do óleo, sob condições térmicas,
foram determinados por análises físico-químicas a partir do seu índice de acidez e
peróxido. Estudou-se a influência do corante individualmente e juntamente com o
antioxidante TBHQ (terc-butilhidroquinona). Todas as análises realizadas
forneceram indícios de que o óleo sofre degradação ao longo do período de
estocagem sob temperatura de 90 °C, no qual este processo degradativo teve maior
efeito nas amostras isentas dos aditivos estabilizantes.
PALAVRAS CHAVES: aditivo alternativo; estabilização; Nabo forrageiro
INTRODUÇÃO: Estudos relacionados à estabilização de óleos utilizados na produção de
biodiesel são relevantes e de suma importância para o desenvolvimento deste
biocombustível. Isto decorre do fato de que os lipídios são constituídos por uma
mistura de tri, di e monoacilgliceróis, ácidos graxos livres, glicolipídios,
fosfolipídios, esteróis entre outras substâncias, sendo a maior parte destes
constituintes oxidáveis em diferentes graus [BERSET, 1996]. Dentre estes, os
ácidos graxos insaturados são os compostos mais susceptíveis ao processo
degradativo [COSGROVE, CHURCH e PRYOR, 1987]. Entretanto, é possível reduzir
este processo utilizando agentes estabilizantes, tais como os antioxidantes
[FERRARI, SOUZA, 2009; LUTZ, 1985; MORETO, FETT, 1998; QUINTELLA, 2009).
Portanto, a estabilidade dos óleos utilizados como matéria prima na produção de
biodiesel também está diretamente ligado a qualidade do biocombustível. Assim
sendo, neste trabalho objetivou-se estudar a estabilização do óleo extraído de
Nabo forrageiro (Raphanus sativus L.) após a adição do corante Solvente Azul 35
(SA-35).
MATERIAL E MÉTODOS: A degradação do óleo foi realizada mediante o processo acelerado com exposição
das amostras em estufa com temperatura de 90 ºC por 504 horas. Para
acompanhamento deste processo, quatro amostras foram preparadas com os aditivos
de interesse, cujas amostras e concentrações nas mesmas foram: (Amostra 1)
corante SA-35 (10 mg/L) + TBHQ (50 mg/L); (Amostra 2) SA-35 10,0 mg/L; (Amostra
3) TBHQ 500 mg/L e (Amostra 4) isenta dos aditivos. Durante este processo,
coletou-se alíquotas a cada 72 horas, e determinou-se os parâmetros de
estabilidade mediante análises de acordo com as normas da American Society of
Testing and Materials (ASTM) e metodologias reportadas na literatura [FERRARI,
SOUZA, 2009; LUTZ, 1985; MORETO, FETT, 1998].
Para análise do índice de acidez (IA), foram pesados cerca de 2,0 g das amostras
de óleo em erlenmeyers e, a seguir, dissolvidas com solventes apropriados.
Titulou-se a mistura com hidróxido de sódio (0,010 mg/L) empregando o método
clássico via indicador fenolftaleína.
Na análise para determinação do Índice de Peróxido (IP), também empregou-se o
método clássico de titulação. Para realização de tal análise, pesou-se 2,50 g da
amostra do óleo em frasco erlenmeyer – dissolveu-se em solvente apropriado e
após repouso por um minuto – titulou-se com solução de tiossulfato de sódio
(0,010 mg/L).
RESULTADOS E DISCUSSÃO: Observou-se que na análise do IP, houve um aumento significativo apenas para a
amostra de óleo isenta dos aditivos, indicando que a formação de peróxidos
ocorreu rapidamente após o período de armazenamento (Fig. 1). Para a amostra de
óleo acrescido da mistura do corante SA-35 (10 mg/L) e do TBHQ (50 mg/L),
verificou-se maior resistência com relação à formação de peróxidos, sendo menos
susceptível a degradação frente às condições de estocagem. Em relação a amostra
contendo apenas o SA-35 (em concentração de 10 mg/L) o IP foi inferior a amostra
controle, sendo que seus valores foram, praticamente, semelhantes a amostra
contendo a mistura (SA-35 + TBHQ). Na amostra contendo apenas o TBHQ (500 mg/L),
não houve variação significativa do IP durante todo o tempo de exposição a
temperatura de 90 ºC. Entretanto, cabe salientar que, esta concentração é 50
vezes maior que a concentração do SA-35 (10 mg/L), cujos resultados permitem
inferir que este corante pode ser uma alternativa eficiente na estabilização de
óleos bem como do biodiesel durante as diversas etapas de manuseio e estocagem.
Para o estudo do IA, observou-se um comportamento semelhante ao estudo do IP. Na
amostra isenta dos aditivos, observou-se que a degradação aumentou
gradativamente durante todo intervalo de avaliação, evidenciando maior
suscetibilidade à oxidação. Entretanto, para as demais amostras, contendo os
aditivos de interesse, o IA apresentou um comportamento semelhante ao verificado
para o estudo do IP, novamente, indicando que o corante SA-35 atendeu
satisfatoriamente aos objetivos iniciais deste trabalho.
Figura 1
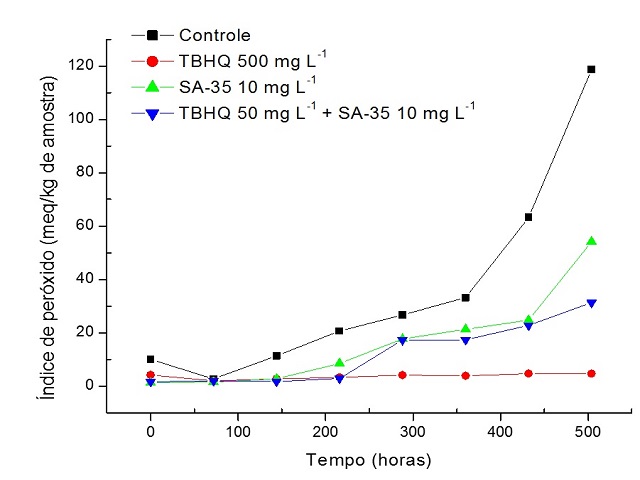
Variação do índice de peróxido ao decorrer do tempo
de estocagem, em estufa, sob temperatura controlada
de 90 ºC.
CONCLUSÕES: Estudos adicionais deverão ser realizados para complementar os resultados
apresentado neste trabalho. Entretanto, estes resultados iniciais evidenciam que o
corante SA-35 pode ser uma alternativa viável na estabilização do óleo extraído de
Nabo forrageiro (Raphanus sativus L.), uma vez que a concentração em estudo foi
menor do que o antioxidante TBHQ, convencionalmente empregado para este fim, na
qual sua concentração foi de 500 mg/L. Sendo assim, os dados de IA e IP são
satisfatórios e atendem aos objetivos iniciais deste trabalho.
AGRADECIMENTOS: Os autores agradecem ao apoio financeiro do CNPq, CAPES, FUNDECT e UFGD.
REFERÊNCIAS BIBLIOGRÁFICA: [1]. BERSET, C.; CUVELIER, M. E.; Sciences des aliments 1996, 16, 219
[2]. COSGROVE, J. P.; CHURCH, D. F.; PRYOR, W. A.; Lipids 1987, 22, 299
[3]. FERRARI, R.A.; SOUZA, W.L. Química Nova, v. 32, p. 106-111, 2009.
[4]. LUTZ, A. Métodos químicos e físicos para análise de alimentos. 3ª ed., São Paulo, 1985.
[5]. MORETTO, E.; FETT, R. Tecnologia de Óleos e Gorduras Vegetais. São Paulo: Varela, 1998. 150 p.
[6]. QUINTELLA, C.M. et al. Quím. Nova, v. 32, p. 793-808, 2009.
