Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Química Analítica
TÍTULO: Desenvolvimento de uma metodologia para a determinação do herbicida Linuron em amostras de água de torneira e de leite utilizando voltametria de onda quadrada e eletrodo de pasta de carbono.
AUTORES: Siara, L.R. (UEMS) ; Oliveira, P.A. (UEMS) ; Maximiano, E.M. (UEMS) ; Arruda, G.J. (UEMS)
RESUMO: Este trabalho mostra uma metodologia, utilizando eletrodo de pasta de carbono
(CPE) como eletrodo de trabalho e voltametria de onda quadrada (SWV), para
determinação eletroanalítica do herbicida Linuron em amostras de água de torneira
e de leite. O limite de detecção determinado foi de 13 ppb e obteve-se uma
recuperação entre 98 – 100 % utilizando o método de adição padrão, o que indica
que o método proposto pode ser utilizado para analisar Linuron em água e em
leite.
PALAVRAS CHAVES: Linuron; SWV; CPE
INTRODUÇÃO: Herbicidas feniluréia controlam seletivamente a germinação de ervas daninhas de
folhas largas e gramíneas em todos os tipos de culturas (KARU et al., 1994). Por
causa de seu uso generalizado, o controle de resíduos em solo e em águas de rios
é muito importante. Concentrações na ordem de partes por milhão desta classe de
herbicidas pode afetar o desenvolvimento embrionário e neonatal de peixes e
invertebrados aquáticos (HERNANDEZ et al., 1990). Uma das mais importantes
uréias comerciais é o herbicida Linuron, ou 3 - [3,4 - (diclorofenil)-1-metoxi-
1-metilureia] que apresenta boa atividade de contato e capacidade de matar mudas
de plantas daninhas emergentes (KATSUMATA et al., 2007). Embora a maioria dos
métodos multiresíduos desenvolvido para a determinação de feniluréia em água,
solo e matrizes de plantas estão baseados nas técnicas cromatográficas (HANCE,
1970), estudos eletroanalíticos deste herbicida foram desenvolvidos e relatados
(LIMA et al., 2011), (DORDEVIC et al., 2012). Este trabalho tem como objetivo
determinar eletroanaliticamente o Linuron em amostra de água de torneira e de
leite utilizando voltametria de onda quadrada (SWV) e eletrodo de pasta de
carbono como eletrodo de trabalho (CPE).
MATERIAL E MÉTODOS: Equipamentos: A célula eletroquímica utilizada nas medidas voltamétricas foi uma
célula de vidro, de compartimento único e com capacidade de aproximadamente 25
mL com três eletrodos. O eletrodo de pasta de carbono com área geométrica de
1,49 x 10-3 cm2 como eletrodo de trabalho, eletrodo de fio
de platina como eletrodo auxiliar e eletrodo de prata/cloreto de prata (Ag/AgCl)
como referência. As medidas eletroquímicas foram realizadas em um
Potenciostato/Galvanostato AUTOLAB PGSTAT-12 interfaceado a um computador e
gerenciado pelo software GPES 4.9 para aquisição dos dados. Para as medidas de
pH utilizou-se um pHmetro HANNA Instruments HI 3221. Reagentes: A solução de
estoque de Linuron foi preparada pela diluição de quantidades conhecidas em
70/30 (água/acetonitrila) do padrão de Linuron da Riedel-deHaën® com pureza de
99,7%. O tampão utilizado foi Britton-Robinson (BR) que foi obtido pela adição
de volumes iguais de ácido bórico (VETEC), ácido fosfórico (SYNTH) e ácido
acético (NUCLEAR) todos com concentração de 0,2 mol L-1. O ajuste de
pH foi realizado pela adição de hidróxido de sódio (MERCK) com concentração de
0,2 mol L-1. Metodologias: O eletrodo de trabalho foi preparado
fazendo a maceração por 40 minutos, em um cadinho de vidro, com pistilo de vidro
na proporção de 75/25% (grafite/nujol). Para as medidas eletroquímicas foram
adicionados em 5 mL do tampão quantidades conhecidas para obter a concentração
desejada do Linuron na célula. Para avaliar a metodologia desenvolvida foram
adicionados aproximadamente 30 ppb da solução de estoque do Linuron em água de
torneira e em leite.
RESULTADOS E DISCUSSÃO: A determinação do herbicida Linuron usando SWV e CPE como eletrodo de trabalho
foi realizada usando parâmetros otimizados na literatura (LIMA et al., 2011). Os
resultados obtidos apresentaram um pico de oxidação em potencial de
aproximadamente 0,38 V (Figura 1A), que pode ser atribuído a oxidação
eletroquímica do Linuron através da perda de grupos metoxi e metila. Este
inicialmente envolve a eliminação do grupo metoxi (substituído por um átomo de
hidrogênio), através da formação de 3-(3,4-diclorofenil)-1-metilureia e ácido
fórmico (DORDEVIC et al., 2012), sendo esse pico utilizado para determinação
eletroanalítica. A curva analítica foi obtida no intervalo de concentração entre
50 – 250 ppb (Figura 1B), observa-se que com as adições sucessivas de Linuron
tem-se um aumento linear da corrente de pico, ou seja, são diretamente
proporcionais. O limite de detecção determinado, utilizando o método da
literatura (LIMA et al., 2011), foi de 13 ppb. A determinação do Linuron foi
realizada pelo método de adição padrão onde foram adicionadas previamente na
água de torneira e no leite quantidades conhecidas do padrão do herbicida
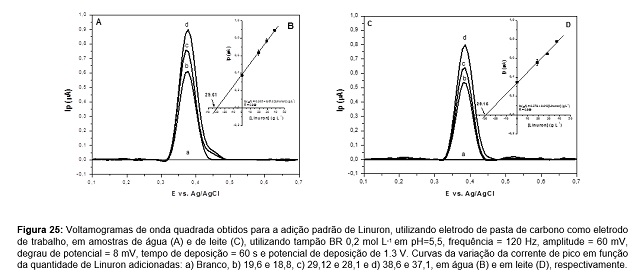
Linuron. São apresentados voltamogramas de SWV e a curva de adição padrão
obtidos para amostras de água e de leite. Os voltamogramas de SWV (Figura 2A),
foram obtidos pela adição padrão em amostra de água de torneira previamente
contaminada com 30 ppb, observa-se um aumento linear da corrente de pico em
função da quantidade adicionada de acordo com equação Ip(µA)=
0,385+0,013[Linuron] (ppb), R=0,999, (Figura 2B), obtendo uma recuperação de
98,7% (29,61 ppb). Resultados semelhantes foram obtidos para a recuperação de
100,1% (29,15 ppb) para uma adição de 29,12 ppb em leite, de acordo com a
equação Ip(µA)= 0,379+0,013[Linuron] (ppb), R=0,999 (Figura 2C,2D).
Figura 1
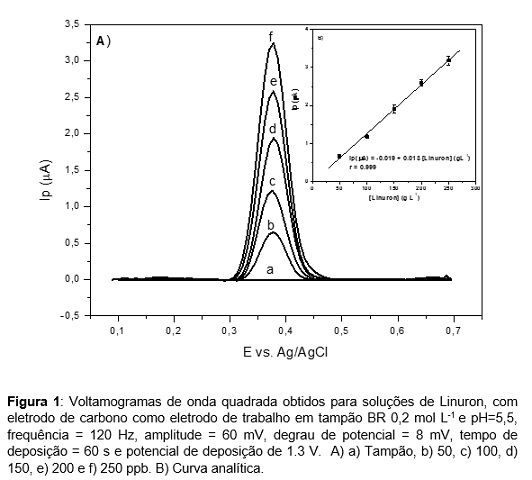
Figura 2
CONCLUSÕES: Os resultados apresentados neste trabalho mostraram que o método eletroanalítico
proposto pode ser aplicado para determinar o Linuron em água e em leite com
sensibilidade e exatidão elevada. O valor do limite de detecção determinado está
abaixo do limite encontrado na literatura e os valores de recuperação obtidos
também mostraram que a metodologia desenvolvida pode ser utilizada na
quantificação do herbicida linuron nas matrizes avaliadas.
AGRADECIMENTOS: UEMS, CNPq e Fundect.
REFERÊNCIAS BIBLIOGRÁFICA: 1. DORDEVIC, J.; PAPP, Z.; GUZSVÁNY, V.; SVANCARA, I. 2012. Sensors 12: 148-161.
2. HANCE, R. J. 1970. Pestic. Sci. 1: 112.
3. HERNANDEZ, P.; VICENTE, J.; GONZALEZ, M.; HERNANDEZ, L. 1990. Talanta 37: 789.
4. KARU, A. E.; GOODROW, M. H.; SCHMIDT, D. J.; HAMMOCK, B.D.; BIGELOW, M.W.; AGRIC J. 1994. Food Chem., 42: 301.
5. KATSUMATA, H.; ASAI, H; KANECO, S.; SUZUKI, T.; OHTA, K. 2007 Microchem Journal. 85: 285.
6. LIMA, F.; GOZZI, F.; FIORUCCI, A. R.; CARDOSO, C. A. L.; ARRUDA, G. J.; FERREIRA V. S. 2011. Talanta. 83: 1763-1768.
