Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Química Analítica
TÍTULO: Utilização de Extrato de Antocianina e Betalaína como indicadores de pH.
AUTORES: Ozorio, F.M. (IFRJ) ; Caldas, L.F.S. (IFRJ)
RESUMO: O presente trabalho tem como objetivo observar o comportamento de extratos de
vegetais e frutas contendo antocianinas e as betalaínas em uma reação de
neutralização, por apresentarem variação na coloração através da mudança de pH,
esses extratos podem ser utilizados como indicadores de pH. Os extratos
utilizados foram obtidos através da trituração da amora, beterraba, uva e
repolho roxo em etanol. Para análise comparativa entre os extratos e a
fenolftaleína foi feita a titulação de ácido forte com base forte. Após a
titulação pode-se verificar a faixa de viragem dos extratos que foi entre pH 6,5
a 8 e a faixa de viragem da fenolftaleína foi entre pH 8 a 10. A titulação com
indicadores a partir dos extratos demonstra que esses indicadores é tão eficaz
quanto à fenolftaleína.
PALAVRAS CHAVES: Antocianinas; Indicadores; Titulação
INTRODUÇÃO: Antocianinas são substâncias fenólicas da classe dos flavonóides. Algumas
subclasses dos flavonóides apresentam variações de coloração na natureza. As
antocianinas são encontradas nas cores azul, roxa e vermelha(TAIZ, 2004). Estão
presentes no repolho roxo, morango, uva, amora, cereja, jabuticaba, maçã,
(MALACRIDA,2006). Suas formas de coloração podem variar de acordo com o valor do
pH.
Esses indicadores visuais quando em meio ácido apresentam coloração avermelhada,
em meio básico apresentam coloração azulada e quando se encontra em meio neutro
apresenta coloração violeta,(CAVALHEIRO, 1998). Outro pigmento natural que é
localizado em algumas famílias de plantas é a betalaína este pigmento se
encontra no vacúolo das células nas plantas. As colorações mais encontradas
desse pigmento são a vermelha e a amarela,(RENHE, 2009).
Como são de fácil obtenção e de baixo custo, os extratos que se constituem de
antocianinas e de betalaínas são capazes de ser utilizados para aulas
experimentais de química analítica, para determinação da constante de ionização
de indicadores, química instrumental, para verificação da lei de Lambert-Beer e
espectrofotometria molecular e química geral, como indicadores ácido-base.
MATERIAL E MÉTODOS: Obtenção dos extratos: As frutas de amora foram previamente lavadas com água
destilada, em um Becker foram pesados 30 gramas em uma balança analítica das
frutas, em seguida as frutas foram trituradas em um liquidificador com filtro,
com 60 mL de álcool etílico, o extrato obtido foi filtrado e armazenado em
geladeira. As frutas de uva e jabuticaba foi previamente lavada com água
destilada, em seguida foi retirada a casca da uva e da jabuticaba. Pesou-se 30
gramas das cascas provenientes da uva e da jabuticaba, em seguida as cascas
foram trituradas em um liquidificador com filtro, com 60 mL de álcool etílico, o
extrato obtido foi filtrado e armazenado em geladeira.
A beterraba foi lavada com água destilada e em seguida foram pesado 30 gramas
em uma balança analítica das frutas, em seguida foram triturados em um
liquidificador com filtro, com 60 mL de álcool etílico, o extrato obtido foi
filtrado e armazenado em geladeira.
O repolho foi previamente lavadas com água destilada, em um Becker foram
pesados 30 gramas em uma balança analítica das frutas, em seguida as frutas
foram trituradas em um liquidificador com filtro, com 60 mL de álcool etílico, o
extrato obtido foi filtrado e armazenado em geladeira.
As soluções Tampão foram preparadas pelo método proposto pela farmacopéia
brasileira(Vol 1,cap 14, p 506-510). Os valores de pH das soluções preparadas
foram: 2,0; 6,0; 8,0;11,0 e
13,0.
As soluções de NaOH e HCl foram preparadas e padronizadas de acordo com a
metodologia proposta pelo Baccan,(2001).Para a titulação ácido base, foram
utilizados as seguintes materiais: pipeta volumétrica de 10 mL e 100 mL; balão
volumétrico de 250 mL, Erlenmeyer de 250 mL, Proveta de 50 mL, bureta de 10 mL,
pipeta pasteur de 3 mL e fita indicadora de pH.
RESULTADOS E DISCUSSÃO: As soluções indicadoras foram adicionadas a soluções tampões de diferentes pH, a
figura 1 apresenta a variação da coloração. A diferença entre as cores obtidas
entre os vegetais testados é devido à quantidade e ao tipo de antocianina
presente nos extratos.
Na tabela 1 podem-se comparar os volumes obtidos através da titulação do ácido
clorídrico 0,1 mol L-1 com hidróxido de sódio 0,1 mol L-1 utilizando os extratos
como indicadores e a fenolftaleína. Foi observada a mudança de coloração dos
indicadores durante a titulação. Inicialmente tinha-se uma solução de coloração
vermelha em meio ácido e em meio básico a coloração era verde.
Figura 1: Extratos em soluções tampões de diferentes pH.

Diferentes extratos de antocianinas adicionados a
solução tampão com valores diferentes de pH.
Volumes obtidos através da titulação de HCl 0,1N com NaOH 0,1N
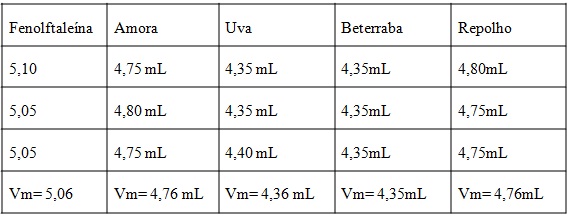
Resultados da titulação de HCl 0,1N com NaOH 0,1N
utilizando diferentes extrato e fenolftaleína como
indicadores de pH.
CONCLUSÕES: A partir dos resultados obtidos pode-se concluir que os extratos contendo
antocianinas e betalaínas podem ser utilizados como indicadores de pH. Os valores
obtidos pela titulação com indicadores a partir dos extratos de antocianinas e de
betalaínas demonstra que a utilização desses indicadores é tão eficaz quanto a
utilização da fenolftaleína como indicador para titulação de ácido forte com base
forte.
AGRADECIMENTOS: Ao IFRJ pelo Apoio Financeiro.
REFERÊNCIAS BIBLIOGRÁFICA: ANVISA, Farmacopéia Brasileira, Vol. 1, 5ª Ed., Brasília, p 506-510, 2010.
BACCAN, N., DE ANDRADE, J.C., GODINHO, O.E.S. Química Analítica Quantitativa Elementar, 3° edição, Editora Edgard Beucher LTDA, p 45 a 61, 215 a 220, 2001.
CAVALHEIRO E.T.G; COUTO, A.B; RAMOS, L.A. Aplicação de pigmentos de flores no ensino de química. Química Nova, 21(2) (1998).
MALACRIDA C.R; MOTTA S.D. Antocianinas em suco de uva: composição e Estabilidade. B.CEPPA, Curitiba, v. 24, n. 1, jan./jun. 2006.
RENHE, I.R. T.; STRINGUETA P.C.; VOLP A C p Pigmentos naturais bioativos. Alimento e Nutrição., Araraquara v.20, n.1, p. 157-166, jan./mar. 2009.
TAIZ L.; ZEIGER. E.Fisiologia vegetal. 3 ed.Porto Alegre:Artmed, p. 320-321, 2004.
