Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Química Inorgânica
TÍTULO: Síntese e Caracterização de Complexos de Co(II), Ni(II) e Cu(II) utilizando-se o ligante 2-Furanocarboxaldeído oxima
AUTORES: Albuquerque, T.B. (UFGD) ; Dias, K.B. (UFGD) ; Filho, E.B. (UFGD) ; Ciola, R. (UFGD) ; Assunção, E.L. (UFGD) ; Darbem, M.P. (UFGD) ; Duarte, B.F. (UFGD) ; Nunes, F.O. (UFGD) ; Rinaldi, A.W. (UEM) ; Domingues, N.L.C. (UFGD)
RESUMO: O presente estudo reporta os resultados de síntese e caracterização de complexos
derivados do ligante 2-furanocarboxaldeído oxima contendo os metais cobalto (II),
níquel (II) e o cobre (II). O ligante e os complexos obtidos foram caracterizados
por espectroscopia de absorção na região do infravermelho (IV), espectroscopia de
absorção na região do ultravioleta-visível (UV-Vis) e difração de raios-X de pó
(DRX), sendo também o ligante caracterizado por cromatografia gasosa acoplada com
o detector de massas CG/MS. Por meio dos resultados obtidos com as análises pode
se verificar o sucesso na síntese do ligante e dos complexos obtidos.
PALAVRAS CHAVES: 2-Furanocarboxaldeído; Cloridrato de Hidroxilami; DRX
INTRODUÇÃO: Oximas são compostos orgânicos cuja estrutura possui a fórmula geral RR’C=NOH,
no qual o grupamento R é um substituinte orgânico e R’ pode ser um hidrogênio ou
um grupo orgânico qualquer [TÜRKKAN et al., 2012]. A síntese de oximas envolve o
refluxo de uma solução alcoólica do aldeído ou cetona, utilizando como amina
primária o cloridrato de hidroxilamina na presença de acetato ou hidróxido de
sódio [DAMLJANOVIC et al., 2006].
O interesse nesta classe de compostos continua a aumentar como consequencia da
ampla aplicação devido suas atividades: antibacteriana, anti-inflamatória,
atividade imunossupressora, inseticida, herbicida, fungicida [ABELE et al.,
2007]. Complexos derivados de oximas apresentaram atividade citotóxica em
células linfoblásticas leucêmicas murinas L-1210 e em tumores sólidos [HALL, et
al.; 1999].
A vantagem indiscutível dessa classe de ligantes é a sua capacidade de
coordenar-se ao centro metálico, tendo dois possíveis sítios de coordenação: o
átomo de nitrogênio da imina e o átomo de oxigênio da hidroxila, desprotonada ou
não, tendo a possibilidade de ocorrer a ligação ao metal em diferentes modos de
coordenação, podendo ainda formar ligações de hidrogênio intra ou intermolecular
[MILIOS et al.; 2006]. Diante disso, o presente trabalho tem como objetivo
otimizar uma rota sintética para o ligante e os complexos, visando investigar as
propriedades espectroscópicas estruturais utilizando as técnicas de IV, UV-Vis e
DRX.
MATERIAL E MÉTODOS: O ligante foi sintetizado partindo-se da uma mistura de 2-furanocarboxaldeído
(0,10 mol) e cloridrato de hidroxilamina (0,13 mol) em etanol sendo adicionado
gota a gota uma solução aquosa de carbonato de sódio (0,05 mol). Em seguida a
reação foi aquecida e mantida em refluxo por 4 horas, e o produto obtido foi
extraído com acetato de etila, seco com sulfato de sódio anidro, rotaevaporado e
purificado por coluna cromatográfica (eluente: acetato de etila/hexano 2:8). Os
complexos foram sintetizados a partir de uma reação de proporção molar 2:1 entre
o ligante 2-furanocarboxaldeído oxima e o sal metálico, usando como solvente
etanol, como representado na Figura 1. O ligante foi previamente desprotonado
com uma solução hidróxido de potássio (2 mols), e em seguida foi adicionado in
situ 1 mol do cloreto metálico (M=Co2+, Ni2+ e Cu2+). A solução foi mantida sob
agitação magnética a temperatura ambiente por um período de 6 horas sendo que ao
término desse período os precipitados obtidos foram lavados com etanol a frio e
filtrados.
RESULTADOS E DISCUSSÃO: O ligante foi obtido na forma de um sólido cristalino branco, e caracterização
por meio da espectroscopia na região do IV apresentando bandas características
do grupo oxima, que são os estiramentos OH em 3288 e 3164 cm-1, o estiramento
C=N em 1645 cm-1 e a deformação N-OH em 970 cm-1. Foi observado no espectro de
UV-Vis uma única banda de absorção decorrente da transição n→π* e ocorre em ca.
266 nm. O ligante também foi caracterizado por CG/MS e o espectro de massas
apresentou pico base definido em m/z 111 (M+H+), compatível com a massa da
estrutura proposta. Nos espectros de IV dos complexos obtidos, observa-se a
presença de largas bandas na região de 3600 a 3100 cm-1 que podem ser atribuídas
a presença de água de hidratação ou de coordenação na estrutura dos complexos; a
banda referente a ν(=N-O) está deslocada para maiores comprimentos de onda
(Co:1015 cm-1, Ni: 1015 cm-1 e Cu:1023 cm-1) fornecendo indícios que o oxigênio
do grupo oxima participa da coordenação ao metal. Segundo a literatura (BOUET e
DUGUÉ, 1990), o ânion 2-furanocarboxaldeído oximato exibe a tendência de ser um
ligante bidentado, e a formação do complexo ocorre por meio da complexação do
metal com os oxigênios da oxima e do anel furânico, formando-se assim um
complexo mais estável. O surgimento de duas novas bandas na região de baixa
frequência ( Co:687 e 464 cm-1, Ni: 681 e 430 cm-1 e Cu: 670 e 482 cm-1) podem
ser atribuídas a coordenação do metal ao oxigênio da oxima e ao oxigênio do anel
furânico respectivamente. A formação dos complexos ocasionou deslocamentos
hipocrômico e hipsocrômico nos espectros de UV-VIS obtidos. Os difratogramas de
raio-X em pó dos complexos apresentaram alta taxa de cristalinização, e os
complexos podem ser considerados isoestruturais.
Figura 1:
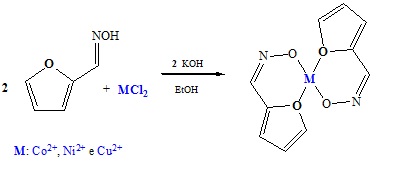
Esquema da síntese dos complexos metálicos
propostos.
CONCLUSÕES: De acordo com os objetivos propostos, envolvendo a síntese e caracterização do
ligante 2-furanocarboxaldeído oxima e seus respectivos complexos, pode se concluir
que as sínteses realizadas foram consideradas satisfatórias. Com a desprotonação
do ligante, o ânion 2-furanocarboxaldeído oximato atua como um ligante bidentado,
coordenando-se ao centro metálico por meio do oxigênio do grupo oxima e do
oxigênio do anel furânico.
AGRADECIMENTOS: Os autores agradecem ao CNPQ, UFGD e ao FUNDECT. Dias, K.B. agradece a CAPES pela
bolsa.
REFERÊNCIAS BIBLIOGRÁFICA: ABELE, E.; ABELE, R.; LUKEVICS, E. Chemistry Heterocyclic Compounds, v.43(8), p. 945–977, 2007.
BOUET, G. M.; DUGUÉ, J. Transition Metal Chemistry, v.15(4), p.257–263, 1990. DAMLJANOVIC, I.; VUKICEVIC, M.; VUKICEVIC, R. D. Monatshefte für Chemie, v.137(3), p. 301–305, 2006.
HALL, I. H.; BASTOW, K. F.; WARREN, A. E.; BARNES, C. R.; BOUET, G. M. Applied Organometallic Chemistry, v.13(11), p.819–828, 1999.
MILIOS, C.J.; STAMATATOS, T.C.; PERLEPES, S.P. Polyhedron, v. 25(1), p.134–194, 2006.
TÜRKKAN, B.; ÖZYÜREK, M.; BENER, M.; GÜÇLÜ, K.; APAK, R. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, v.85(1), p. 235–240, 2012.
