Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Química Inorgânica
TÍTULO: Síntese, caracterização e atividade biológica in vitro de complexos de Sn(IV) com ligantes triazólicos
AUTORES: Almeida, P.S.V.B. (UFV) ; Falqueto, M.C. (UFV) ; Santos, A.F.S. (UFV) ; Maia, J.R.S. (UFV) ; Menezes, D.C. (UFV)
RESUMO: Compostos triazólicos bem como seus derivados organoestânicos foram sintetizados e caracterizados por infravermelho (IV), ponto de fusão e ressonância magnética nuclear (RMN) de 1H e 13C, sendo esta ultima técnica apenas para os ligantes triazólicos. O potencial antimicrobiano foi medido através do teste de difusão em Agar onde os ligantes apresentaram baixa atividade em relação aos complexos os quais apresentaram uma atividade comparável ao fármaco Norfloxacino. Este resultado sugere que os organoestânicos derivados de triazóis têm potencial para formulação de novos medicamentos
PALAVRAS CHAVES: Organoestânicos; Triazol; Antimicrobiano
INTRODUÇÃO: 1,2,4-triazol e seus derivados constituem uma classe interessante de heterociclos que ganhou atenção considerável nos últimos anos pois representam um híbrido de pirazole imidazol em relação ao arranjo dos átomos de azoto do anel. Eles também possuem um amplo espectro de atividades biológicas, incluindo atividades de antimicrobianos e antifúngicos, como exemplo, fluconazol, itraconazol que têm sido amplamente utilizados para o tratamento e profilaxia de uma variedade de infecções fúngicas. Vários novos agentes triazólicos estão em várias fases de ensaios clínicos e pré-clínicos e pode estar disponível para uso humano no futuro próximo. Além disso, eles apresentam uma capacidade de coordenação versátil, especialmente quando o núcleo triazol está substituído com grupos doadores adicionais (NATH et al., 2006). Compostos organoestânicos têm recebido atenção crescente nos últimos anos em razão da sua atividade biológica na indústira química. A aplicação dos organoestânicos envolve a sua utilização como catalisadores e estabilizantes, biocidas, agentes anti-deposição e para a preservação da madeira. Nos últimos anos, investigações têm sido realizadas para testar suas atividades biológicas como antitumorais e tem-se observado que, vários precursores diorganoestânicos como o diclorodimetilestanho [(CH3)2SnCl2] apresentam potencial como agentes antineoplásicos, antimicrobianos dentre outros (MUHAMMAD et al., 2009; WIECEK et al., 2009). O presente trabalho tem como objetivo reportar a síntese e caracterização dos complexos de estanho (IV) e de seus respectivos ligantes 5-amino-1H-1,2,4-triazol bem como sua atividade antimicrobiana frente cepas certificadas de Escherichia coli e Staphylococcus aureus.
MATERIAL E MÉTODOS: Os ligantes 5-amino-1H-1,2,4-triazóis foram sintetizados a partir de reações equimolares (1:1) entre bicarbonato de aminoguanidina e os ácidos carboxílicos, ácido acético (L1 - 5-amino-3-metil-1H-1,2,4-triazol) e ácido benzóico (L2 - 5-amino-3-fenil-H-1,2,4-triazol) como descrito na literatura (BOECHAT et al., 2011). Os complexos foram preparados mediante reação equimolar entre o diclorodimetil estanho (IV) e os respectivos ligantes em etanol, sob refluxo e agitação, por 10h à 80°C. Os complexos e os ligantes foram caracterizados por ponto de fusão e espectroscopia no infravermelho (IV) e, os ligantes também por ressonância magnética nuclear (RMN) de 1H e 13C. O teste biológico foi realizado pela técnica de difusão em Agar, frente cepas certificadas de E. coli (ATCC 11229) e S.aureus (ATCC 25923) onde 100μL da solução das bactérias, em meio "nutrient broth", foi espalhado sobre Agar nutriente previamente preparado. Discos de papel (6 mm) foram adicionados às placas e sobre estes vertidos 10 μL de solução dos ligantes e complexos, dissolvidos em dimetilsulfóxido (DMSO), na concentração de 250 mmol L-1. As placas foram incubadas por 24 h a 37 °C e, em seguida, procedeu-se a leitura dos halos de inibição (mm). O medicamento Norfloxacino e o DMSO foram utilizados como controle positivo e negativo, respectivamente e todos os ensaios foram realizados em triplicata.
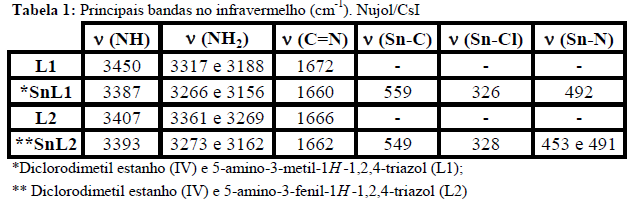
RESULTADOS E DISCUSSÃO: L1 e L2 apresentaram ponto de fusão de 130-132°C e 179-182°C respectivamente e de 167-169°C para SnL1 e 230-232°C para SnL2. O RMN de 13C para L1 apresentou deslocamentos em 179.49 e 159.84 para os carbonos do anel triazólico e de 23,13 para o carbono do substituinte metila e RMN de 1H apresentou valores de 1.9, 5.07 e 4.5 referentes à CH3, NH2 e NH respectivamente. Para L2 tem-se deslocamentos de 174,52 e 159,86 para os carbonos do heterociclo e 137.62-127.60 para o ligante fenila e RMN de 1H apresentou valores de 7.95-7,35 para o grupo fenil, 4,93 para NH2 e 4,52 para NH (SILVERTEIN e WEBSTER, 2000; ABDEL-MEGEED et al., 2009). No IV ligantes e complexos apresentaram estiramentos na região de 3300-3500 cm-1 referentes às ligações NH/NH2 e de 1630-1690 referentes a C=N sendo que nos complexos esses estiramentos apresentaram deslocamento significativo demonstrando a complexação via grupos amino (ver Tabela 1) (BARBOSA, 2007). Os complexos apresentaram estiramentos referentes às ligações Sn-C, Sn-Cl além de bandas em regiões de baixa frequência referente às ligações Sn-N o que corrobora com a coordenação via átomos de nitrogênio do ligante (MENDES et al., 2008; SEDAGHAT et al., 2012; SHAZADI et al., 2006). Ligantes apresentaram baixa atividade antimicrobiana frente às cepas estudadas. Já os complexos demonstraram uma atividade considerável onde SnL1 e SnL2 apresentaram uma inibição de 100,74% e 89,63% frente S.aureus e 92,94% e 70,16% para E.coli respectivamente sendo esses resultados obtidos em relação à inibição apresentada pelo medicamento referência (Tabela 2).

CONCLUSÕES: Complexos de Sn (IV) derivados de triazóis substituídos foram sintetizados e caracterizados apresentando rendimento em uma faixa de 70 a 95% além de atividade antimicrobiana numa faixa de 70 à 100% de inibição frente cepas de bactérias gram positivas e gram negativas podendo, assim, serem considerados uma nova fonte de estudo para desenvolvimento de fármacos antimicrobianos.
AGRADECIMENTOS: FAPEMIG, CNPq, CAPES, DEQ-UFV.
REFERÊNCIAS BIBLIOGRÁFICA: ABDEL-MEGEED, A. M., ABDEL-RAHMAN, H. M., ALKARAMANY, G.-E. S., & EL-GENDY, M. 2009. Design, synthesis and molecular modeling study of acylated 1,2,4-triazole-3-acetates with potential anti-inflammatory activity. European journal of medicinal chemistry, 44:117–23.
BARBOSA, L. C. A. 2007. Espectroscopia no Infravermelho na caracterização de compostos orgânicos. Editora UFV, 1ª ed.
MENDES, I. C., MOREIRA, J. P., ARDISSON, J. D., SANTOS, R. G. DOS, DA SILVA, P. R. O., GARCIA, I., CASTIÑEIRAS, A., BERALDO, H. 2008. Organotin(IV) complexes of 2-pyridineformamide-derived thiosemicarbazones: antimicrobial and cytotoxic effects. European journal of medicinal chemistry, 43:1454–61.
MUHAMMAD, N., SHAH, A., SHUJA, S., ALI, S., QURESHI, R., MEETSMA, A., TAHIR, M. N. 2009. Organotin(IV) 4-nitrophenylethanoates: Synthesis, structural characteristics and intercalative mode of interaction with DNA. Journal of Organometallic Chemistry, 694:3431–3437.
NATH, M., SONG, X., ENG, G. 2006. Organotin (IV) triazolates: Synthesis and their spectral characterization. Journal of Organometallic Chemistry, 691:1649–1657.
SEDAGHAT, T., NASEH, M., BRUNO, G., AMIRI RUDBARI, H., MOTAMEDI, H. 2012. New diorganotin(IV) complexes with 3-(2-hydroxy-5-methylphenylamino)-1,3-diphenylprop-2-en-1-one: Synthesis, spectroscopic characterization, structural studies and antibacterial activity. Journal of Molecular Structure, 1026:44–50.
SEDAGHAT, T., NASEH, M., KHAVASI, H. R., MOTAMEDI, H. 2012. Synthesis, spectroscopic investigations, crystal structures and antibacterial activity of 3-(3-hydroxypyridin-2-ylamino)-1-phenylbut-2-en-1-one and its diorganotin(IV) complexes. Polyhedron, 33:435–440.
SHAHZADI, S., ALI, S., BHATTI, M. H., FETTOUHI, M., ATHAR, M. 2006. Chloro-diorganotin(IV) complexes of 4-methyl-1-piperidine carbodithioic acid: Synthesis, X-ray crystal structures, spectral properties and antimicrobial studies. Journal of Organometallic Chemistry, 691:1797–1802.
SILVERSTEIN, R. M.; WEBSTER, F. X. 2000. Identificação espectrométrica de compostos orgânicos, 6ª ed., UTC, RJ.
WIECEK, J., DOKOROU, V., CIUNIK, Z., KOVALA-DEMERTZI, D. 2009. Organotin complexes of pyruvic acid thiosemicarbazone: Synthesis, crystal structures and antiproliferative activity of neutral and cationic diorganotin complexes. Polyhedron, 28:3298–3304.
