Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Iniciação Científica
TÍTULO: Adsorção de agroquímico não iônico em hidróxido duplo lamelar derivado de Mg/Fe
AUTORES: Mansão, L.F.O. (UEG) ; Rosseto, R. (UEG)
RESUMO: Uma estratégia para reduzir a lixiviação de agroquímicos para solos e água
consiste na utilização de formulações de liberação controlada. Neste contexto,
matrizes inorgânicas, entre as quais hidróxidos duplos lamelares (HDL), têm se
destacado. O presente trabalho teve como objetivo a preparação de HDL derivado de
Mg/Fe contendo intercalado o ânion dodecil sulfato (DS), para a posterior adsorção
do herbicida não iônico 3-(3,4-diclorofenil)-1,1-dimetilureia (DCMU) à estrutura
funcionalizada. A quantidade de DCMU presente no híbrido HDL-DS-DCMU foi de 27,9%
m/m (DCMU/híbrido), e estudos de dessorção conduzidos em água e em solução tampão
fosfato pH 7 demonstraram perfis semelhantes, com aproximadamente 80% de liberação
do DCMU ocorrendo nos primeiros 60 min da cinética.
PALAVRAS CHAVES: Matrizes hospedeiras; Diuron; Liberação sustentada
INTRODUÇÃO: O herbicida 3-(3,4-diclorofenil)-1,1-dimetilureia (DCMU), também conhecido por
Diuron, é um dos praguicidas mais empregados no controle de ervas daninhas
associadas à cultura canavieira brasileira. O DCMU é um herbicida não
ionizável, apolar, pouco solúvel em água, normalmente não oferece riscos à
lavoura, porém, é considerado muito perigoso ao meio ambiente (MAPA, 2013).
Estudos indicam que a decomposição do DCMU no solo gera intermediários
potencialmente tóxicos (PASCHOALATO et al., 2010), assim ao reduzir a quantidade
do herbicida aplicado, menores serão os riscos de contaminação humana e
ambiental.
Uma das maneiras de prevenir a contaminação de solos e lençóis freáticos
ocasionada pela lixiviação de agroquímicos é através da utilização de sistemas
que liberem de forma sustentada o praguicida para a planta. Os hidróxidos duplos
lamelares (HDL) são candidatos em potencial para o carreamento de princípios
ativos, pois apresentam estruturas flexíveis com alta capacidade de incorporar
espécies negativas na região interlamelar, além de poderem ser obtidos por rotas
sintéticas triviais e de baixo custo (CUNHA et al.,2010).
A adsorção de compostos neutros e apolares em HDL é limitada, já que a estrutura
lamelar é essencialmente iônica. Desta maneira, a funcionalização da matriz
inorgânica com surfactantes negativos, como por exemplo, o ânion dodecil
sulfato, para posteriormente incorporar espécies apolares na cauda hidrofóbica é
uma estratégia viável com grandes oportunidades de pesquisa. Entretanto, apesar
de profícuo a ocorrência desses trabalhos comparados a intercalações de
compostos iônicos é pouco frequente (OTERO et al., 2012).
MATERIAL E MÉTODOS: A síntese dos HDL ocorreu de forma análoga à descrita na literatura (KHAN et
al., 2009) através do método de coprecipitação. A uma solução de 3,92 g de
FeCl3.6H2O e 8,32 g de MgCl2.6H2O em
100 mL de água destilada foi adicionada, vagarosamente, uma solução de 3,40 g de
Na2CO3, 3,50 g de NaOH e 1,21 g de dodecil sulfato de
sódio em 100 mL de água destilada. A mistura foi aquecida a 80°C por 24h. O
sólido de coloração marrom foi separado do sobrenadante por centrifugação,
lavado com água destilada (4 x 250 mL), e seco em estufa a 100°C por 24h, para
se obter 5,52 g (HDL-DS).
A incorporação do DCMU foi realizada a partir de uma dispersão entre 1 g de HDL-
DS e 100 mL de solução 50% água/etanol de DCMU 0,1 mol.L-1, obtida a partir da
diluição de uma amostra comercial de Diuron. A suspensão foi mantida a 60°C por
72h. O sobrenadante foi removido por centrifugação, lavado com 250 mL de
água/etanol (50/50 v/v) e seco a 50°C por 24h para se obter 0,88 g de um sólido
marrom claro (HDL-DS-DCMU).
As amostras preparadas (HDL-DS e HDL-DS-DCMU) foram caracterizadas por
espectroscopia vibracional no infravermelho por refletância atenuada (ATR) com o
auxílio do espectrofotômetro Perkin Elmer Frontier. As liberações do DCMU foram
monitoradas por espectroscopia eletrônica no UV-vis no espectrofotômetro Perkin
Elmer Lambda 25. Para a análise por UV-vis foram preparadas dispersões HDL-DS e
HDL-DS-DCMU utilizando a relação 100 mg do híbrido em 100 mL de água e em
solução tampão fosfato pH 7. Para a análise do DCMU, amostras de HDL-DS-DCMU
foram extraídas com uma mistura água/acetato de etila, e a fração orgânica
analisada por CG-EM no cromatógrafo Shimadzu 2010 Plus, similarmente ao descrito
na literatura (PEÑA, et al.,2002)
RESULTADOS E DISCUSSÃO: Os espectros vibracionais na região do infravermelho do HDL(Mg/Fe) (sem dodecil
sulfato intercalado) e dos híbridos HDL-DS e HDL-DS-DCMU apresentaram bandas
características nas regiões de 3400, 1600 e 1400 cm-1 atribuídas aos
estiramentos –OH, às deformações angulares de água intercalada, e às vibrações
do ânion carbonato intercalado, respectivamente. Para o híbrido HDL-DS, além das
bandas descritas, constataram-se frequências entre 2934 e 2870 cm-1
devido ao estiramento C-H, e em 1180 e 1050 cm-1 atribuídas às
vibrações antissimétricas e simétricas do grupo sulfato, respectivamente. Para o
HDL-DS-DCMU, adicionalmente observou-se frequência em 1740 cm-1
(estiramento C=O do DCMU).
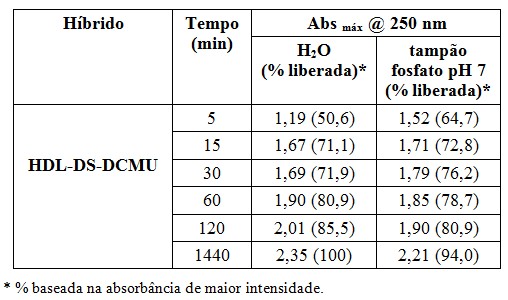
Os dados da liberação do DCMU (Figura 1) no HDL-DS-DCMU em água e tampão fosfato
pH 7
seguem compilados a seguir (Quadro 1). Inicialmente, a liberação do DCMU em
tampão é mais rápida quando comparada com água, provavelmente devido à efetiva
troca iônica do ânion dodecil sulfato por íons fosfato, liberando DCMU para o
meio. Porém, após 1h de reação, a porcentagem de DCMU em água torna-se superior,
sugerindo que a dessorção é dificultada em tampão, devido à eventual limitação
de solubilidade do herbicida em solução de fosfato.
Baseado nas análises de CG-EM do DCMU presentes nos híbridos, além dos espectros
no UV-vis do DCMU em água/etanol e do HDL-DS-DCMU em etanol, estimou-se a
quantidade de herbicida adsorvido ao HDL, sendo de aproximadamente 27,9% m/m.
Verificou-se que a temperatura de secagem do HDL-DS-DCMU tem forte influência
sobre a adsorção do agroquímico, em ensaios onde a secagem ocorreu a 100 ºC, a
presença de DCMU no HDL foi desprezível, devido a perdas por volatilização.
Quadro 1
Evolução da absorbância em 250 nm para o híbrido
HDL-DS-DCMU.
Figura 1
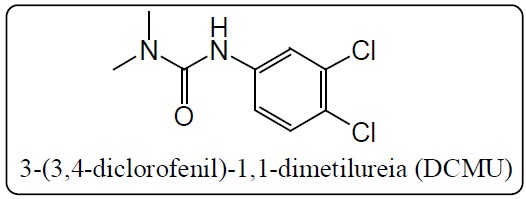
Herbicida 3-(3,4-diclorofenil)-1,1-dimetilureia
(DCMU)
CONCLUSÕES: Os resultados obtidos neste trabalho indicam que os HDL funcionalizados com o
ânion dodecil sulfato podem atuar como carreadores do agroquímico não iônico DCMU.
Visando aperfeiçoar o sistema, ainda faz-se necessário aumentar a quantidade de
herbicida na matriz funcionalizada, além de promover uma maior interação do DCMU
com o ânion intercalado, prolongando ainda mais a liberação do princípio ativo ao
meio. Entretanto, a capacidade adsortiva do HDL-DS frente a compostos orgânicos
sugere a sua utilização como sorvente na remoção de contaminantes apolares.
AGRADECIMENTOS: Os autores agradecem à Universidade Estadual de Goiás pelo fomento e suporte às
pesquisas. LFOM agradece a UEG pela bolsa IC.
REFERÊNCIAS BIBLIOGRÁFICA: MAPA, 2013. Ministério da agricultura, pecuária e abastecimento. Disponível em: http://agrofit.agricultura.gov.br/. Acesso em março de 2013. CUNHA, V.R.R.; FERREIRA, C.M.A.; CONSTANTINO, V.L.R. 2010. Hidróxidos duplos lamelares: Nanopartículas inorgânicas para armazenamento e liberação de espécies de interesse biológico e terapêutico. Química Nova 33: 159-171. KHAN, A.; RAGAVAN, A.; M.; DUNBAR, T.G.; WILLIAMS, G.R.; O’HARE, D. 2009. Recent developments in the use of layered double hydroxides as host materials for the storage and triggered release of functional anions. Industrial Engineering Chemistry Research 48: 10196-10205. OTERO, R.; FERNÁNDEZ, J.M.;ULIBARRI, M.A.; BRUNA, F. 2012. Adsorption of non-ionic pesticide S-Metolachlor on layered double hydroxides intercalated with dodecylsulfate and tetradecanedioate anions. Applied Clay Science 64: 72-79. PASCHOALATO, C.F.P.R.; RAVANELI, M.A.C.; SILVA, B.M. 2010. Toxicidade Aguda dos herbicidas diuron e hexazinona à Danio rerio. Pesticidas 20: 17-28. PEÑA, F.; CARDENAS, S.;GALLEGO, M.;VALCÁRCEL, M. 2002. Analysis of phenylurea herbicides from plants by GC/MS. Talanta, 56: 727-734.
