Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Materiais
TÍTULO: ADSORÇÃO DE CÁDMIO EM EFLUENTE AQUOSO UTILIZANDO COMPÓSITO MAGNÉTICO Mn3O4/Fe3O4.
AUTORES: Heitmann, A.P. (CEFETMG) ; Silva, G.C. (UFMG) ; Ferreira, A.M. (CEFETMG)
RESUMO: O tratamento de efluentes contendo cádmio é de grande interesse devido a sua
persistência no meio ambiente e a graves doenças que podem causar ao homem. No
presente trabalho, foi utilizado o compósito magnético Mn3O4/Fe3O4 como adsorvente
do íon cádmio (II) em meio aquoso. O estudo de adsorção foi realizado variando o
pH do meio e a concentração do íon cádmio em solução. A análise dos resultados
possibilitou verificar que o processo de adsorção utilizando compósito magnético
Mn3O4/Fe3O4 em meio aquoso é dependente do pH e apresentou valores significativos
de adsorção (9,41mgCd/g). Portanto, o estudo de adsorção indica que o adsorvente
apresenta elevado potencial para remoção do íon Cd(II).
PALAVRAS CHAVES: adsorção; compósito magnético; cádmio
INTRODUÇÃO: A poluição do solo e dos sistemas aquáticos por elementos metálicos afeta a
qualidade do meio ambiente e representa risco para a saúde humana (MUNIZ,
OLIVEIRA, 2006; XIN et al., 2012 ). O cádmio é tóxico ao homem quando ingerido
ou inalado, podendo ser depositado e acumulado em vários tecidos do corpo
provocando doenças como disfunção renal, hipertensão e artero-esclerose.
Atualmente, é muito utilizado em alguns processos industriais sendo um poluente
comum em águas residuais e em sedimentos (CORREA et al., 2011). O aumento da
quantidade de água para o consumo humano e uso industrial aliado a leis
ambientais cada vez mais severas tem estimulado o desenvolvimento de materiais e
métodos para o tratamento de soluções aquosas contaminadas (SILVA et al., 2012;
AGUIAR, 2002). Dentre os métodos existentes para remoção de metais em meio
aquoso destaca-se o processo de adsorção, no qual podem ser utilizados
adsorventes de baixo custo e com elevada capacidade de remoção (JIMENEZ; BOSCO;
CARVALHO, 2004). Os adsorventes metálicos com propriedade magnética são novos
materiais com elevada capacidade de adsorção que têm recebido atenção especial
nesses últimos anos. Podem ser utilizados para adsorver contaminantes de
efluentes industriais e ao final da adsorção podem ser separados do meio aquoso
pela simples aplicação de um campo magnético (CASSELLA et al., 2009). Explorando
as características magnéticas e adsortivas dos óxidos de metais de transição
nanoestruturados pode-se obter materiais eficientes e de baixo custo voltados
para o tratamento de águas residuais (CHEN et al., 2011).
MATERIAL E MÉTODOS: Os experimentos de sorção do cádmio foram realizados utilizando soluções de
Cd(NO3)2.4H2O em concentrações de 5-60mg/L, em pH 7, utilizando 0,1g do adsorvente
sob agitação constante de 200rpm e a temperatura de 25°C em um shaker. O efeito do
pH no processo de sorção foi avaliado na faixa de pH 3, 5 e 7, ajustado com
soluções de KOH (1M) e H2SO4 (0,5 M), utilizando Cd(NO3)2.4H2O a uma concentração
de 20mg/L, 0,1g do adsorvente sob agitação constante de 200rpm e a temperatura de
25°C em um shaker. As concentrações de cádmio inicial e final foram determinadas
por AAS (Perkin-Elmer Aanalyst 300).
RESULTADOS E DISCUSSÃO: A variação do pH da solução contendo o íon Cd (II) afeta significativamente a
adsorção desse metal no material adsorvente. Isso ocorre, provavelmente pelo
fato do pH da solução influenciar as cargas superficiais dos adsorventes, assim
como especiação de íons metálicos e, consequentemente, as interações entre os
íons do metal e o adsorvente. Na Fig. 1, a remoção de Cd (II) aumenta com a
elevação do pH apresentando valores de 0,072mg/m2 (pH 3) para 0,159mg/m2 (pH 7).
A remoção variou de 34,6% para 69,8% para pH 3 e pH 7 respectivamente. Segundo
Taffarel e Rubio (2010) com o aumento do pH, a densidade de carga negativa sobre
a superfície do compósito aumenta devido a desprotonação da superfície e assim a
adsorção de cátions é favorecida. A isoterma de sorção do Cd (II) avalia a
capacidade de remoção do íon contaminante em diferentes concentrações no meio
aquoso. A isoterma de adsorção obtida foi ajustada ao modelo de Langmuir,
representada na Fig. 2. A capacidade máxima de adsorção do íon metálico, Qm,
apresentou valor de 9,41mgCd/g (0,0019026mmolCd/m2) e a área superficial
encontrada, utilizando o método BET, do adsorvente foi 44±9 m2/g. O valor de
sorção do Cd(II) é comparável com Naiya et al (2009) empregando alumina ativada
em pH 5, encontrando Qm de 0,00247mmolCd/m2 e superior a capacidade máxima de
adsorção do metal em hausmanita no pH 6,3 (0,000508mmolCd/m2) encontrado por
Backes et al (1995) e por Correa et al (2011) que comparou a adsorção do íon
utilizando goetita e boemita sintética em pH 6 obtendo valores de Qm de
0,000804mmolCd/m2 e 0,000116144mmolCd/m2. O modelo de Languimir (R2=0,99552) é o
que melhor descreve a adsorção do Cd(II) na superfície do adsorvente uma vez que
foi obtido maior valor de R2 quando comparado ao modelo de Freundlich
(R2=0,97325).
Figura 1 - Efeito do pH em solução aquosa de Cd (II).

Figura 1 - Efeito do pH em solução aquosa de Cd
(II).
Figura 2- Isoterma de sorção para o Cd (II) em solução aquosa.
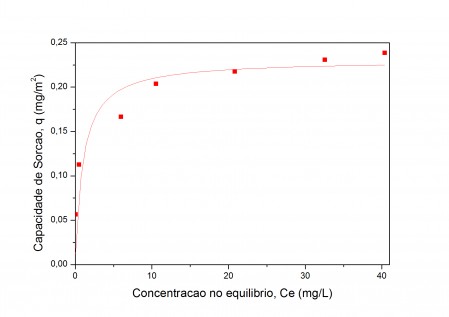
Figura 2- Isoterma de sorção para o Cd (II) em
solução aquosa.
CONCLUSÕES: A análise dos resultados obtidos da adsorção do íon Cd(II) em meio aquoso
utilizando compósito Mn3O4/Fe3O4 permitiu concluir que o processo de adsorção é
dependente do pH e que a maior adsorção do cátion ocorre em pH 7. Além disso, a
capacidade máxima de adsorção do íon foi elevada quando comparada com a
literatura, indicando que o compósito magnético apresenta elevado potencial para
remoção do íon Cd(II) em meio aquoso.
AGRADECIMENTOS: Os autores agradecem ao Laboratório de Hidrometalurgia da UFMG, INCT-Acqua, CEFET-
MG e as agências de fomento CAPES e FAPEMIG.
REFERÊNCIAS BIBLIOGRÁFICA: AGUIAR, M. R. M. P et al. Remoção de metais pesados de efluentes industriais por aluminossilicatos. Química Nova, v. 25, p. 1145-1154, 2002.
BACKES, C. A et al. Kinetics of cadmium and cobalt desorption from iron and manganese oxides. Soil Science Society of America Journal, v. 59, p. 778-785, 1995.
CASSELLA, R. J et al. Polyurethane foam loaded with SDS for the adsorption of cationic dyes from aqueous médium: multivariate optimazation of the loading process. Journal of Hazardous Materials, v.167, p. 653-659, 2009.
CORREA, F. G et al. Comparison of the Cd(II) adsorption processes between boehmite (-AlOOH) and goethite (-FeOOH). Chemical Engineering Journal, v. 171, p. 1027-1034, 2011.
CHEN, H et al. Porous magnetic manganese oxide nanostructures: Synthesis and their in water treatment. Journal of Colloid and Interface Science, v. 359, p. 68-74, 2011.
JIMENEZ, R. S.; BOSCO, S. M.; CARVALHO, W. A. Remoção de metais pesados de efluentes aquosos pela zeólita natural escolecita – influência da temperatura e do pH na adsorção em sistemas monoelementares. Química Nova, v. 27, p. 734-738, 2004.
MUNIZ, D. H. F.; OLIVEIRA, F. E.C. Metais pesados provenientes de rejeitos de mineração e seus efeitos sobre a saúde e o meio ambiente. Universitas: Ciências da Saúde, v. 4, p. 83-100, 2006.
NAIYA, T. K.; BHATTACHARYA, A. K.; DAS, S. K. Adsorption of Cd(II) and Pb(II) from aqueous solutions on activated alumina. Journal of Colloid and Interface Science, v. 33, p. 14-26, 2009.
SILVA, G. C et al. Preparation and application of a magnetic composite (Mn3O4/Fe3O4) for removal of As(III) from aqueous solutions. Materials Research, v. 15, p. 403-408, 2012.
TAFFAREL, S. R.; RUBIO, J. On the removal of Mn2+ ions by adsorption onto natural and activated Chilean zeolites. Minerals Engineering, v. 22, p.336-343, 2009.
XIN, X et al. Highly efficient removal of heavy metal ions by amine-functionalized mesoporous Fe3O4 nanoparticles. Chemical Engineering Journal, v. 184, p. 132-140, 2012.
