Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Bioquímica e Biotecnologia
TÍTULO: Otimização da extração de Peroxidase de farelo de arroz por metodologia de superfície de resposta
AUTORES: Penteado Feltrin, A.C. (FURG) ; Basso Kraus, R. (FURG) ; Waltzer Fehrenbach, G. (FURG) ; da Silveira de Lima, T. (FURG) ; Delgado Kikumoto Gracia, H. (FURG) ; Badiale Furlong, E. (FURG) ; Garda Buffon, J. (FURG)
RESUMO: Este trabalho objetivou avaliar diferentes extrações da peroxidase (PO), com o intuito de padronizar e maximizar sua obtenção a partir de farelo de arroz (FA), para posterior utilização em ensaios de descontaminação ambiental. A otimização partiu de um planejamento experimental tendo como variáveis volume do solvente extrator (15, 32,5 e 50 mL) e intensidade de agitação orbital (100, 200 e 300 rpm), como resposta foram obtidos 28,74 U/mg de PO em extração de 5 g a 100 rpm com 15 mL de solvente extrator. As condições otimizadas no planejamento foram comparadas com outras formas de extração: agitação ultrassônica (25, 37 e 40 Hz) e blender. Após comparação, a melhor obtenção enzimática se manteve a 100 rpm, com observação de diminuição na atividade maior que 50% com utilização de blender.
PALAVRAS CHAVES: Peroxidase; Extração; farelo de arroz
INTRODUÇÃO: Observando o crescimento atual da produção agrícola no Brasil em seus mais diversificados produtos, é notável o destaque que se dá na região Sul pela produção de arroz[1]. Durante o processo de beneficiamento do grão, milhares de toneladas de FA são produzidas. Esse subproduto, um resíduo agroindustrial, apresenta alto valor nutritivo e é largamente empregado na produção de ração animal[2]. De acordo com estudos desenvolvidos com o FA, este é portador de uma alta concentração de proteínas, destacando-se as enzimas que possuem alto valor comercial agregado[3,4].
As enzimas têm sido usadas pelo homem desde a antiguidade, sob a forma de extratos de tecidos animais e vegetais. Conhecidas como biocatalisadores, são empregadas em vários processos industriais. Muitas enzimas, de origem vegetal, são utilizadas no tratamento de efluentes e resíduos industriais para resolver problemas específicos [5], entre as mais estudadas, para fins de descontaminação, destacam-se as enzimas oxidativas, como exemplo a PO. Para obtenção enzimática são utilizados os mais diversos agentes extratores, dependendo da fonte e da localização da enzima (intra ou extracelular). A extração enzimática mais comumente utilizada ocorre pela homogeneização da fonte enzimática em solução tampão adequada.
Considerando a evolução de processos ambientais na gestão de resíduos industriais, em caráter de reutilização, redução da fonte e reciclagem, conceituando assim tecnologias limpas sem o uso de produtos que agridam o meio ambiente, é que esse trabalho avaliou a obtenção da enzima PO a partir de um resíduo agroindustrial, FA.
MATERIAL E MÉTODOS: A extração da enzima PO realizada a partir do subproduto agroindustrial FA, foi baseada em método descrito na literatura [6], onde o meio extrator consistiu em adicionar 5 g de amostra e solvente extrator tamponante, seguido por agitação mecânica durante 60 min a temperatura ambiente. O extrato bruto obtido foi então centrifugado (3220g, 4 °C durante 10 min) e filtrado, e neste quantificada proteína solúvel [7] e atividade específica [8] da PO.
Primeiramente através de um planejamento composto central com duas variáveis em dois níveis, DCC 22, foi avaliada a influência da agitação orbital em três diferentes rotações (100, 200 e 300 rpm) e volume do solvente extrator (15, 32,5 e 50 mL). Objetivando o aumento da obtenção da PO, a condição otimizada foi comparada com outras condições de extração, como: agitação ultrassônica (25, 37 e 40 Hz) durante 60 min e em blender durante 5 minutos. A análise estatística dos dados foi realizada por ANOVA considerando as médias de triplicatas dos ensaios por teste de Tuckey, utilizando o programa “Statistica” (versão 7.0, StatSoft, Inc., Tulsa, USA), tendo atividade específica da PO (U/mg) como resposta das variáveis em estudo.
RESULTADOS E DISCUSSÃO: Utilizando como ponto de partida para a otimização da extração um DCC 22, para avaliação da influência das variáveis intensidade da agitação orbital (100, 200 e 300 rpm) e volume do solvente extrator (15, 32,5 e 50 mL), sobre a extração da enzima PO a partir de FA e os resultados encontrados em termos de atividade específica da PO, objetivando posterior aplicação em processos de descontaminação ambiental. Durante a análise dos resultados do planejamento se observa que as variáveis agitação, volume e a interação entre elas apresentam efeito significativo (p<0,05) sobre a atividade da PO (U/mg). No modelo gerado para atividade específica da PO obtida de FA, o valor de F calculado foi de 25,23, o que significa 2,72 vezes maior que o F tabelado 9,28, com um coeficiente de correlação (R) de 0,96. Estes resultados implicam em um modelo preditivo e significativo, o que possibilita a geração de um modelo de superfície de resposta representado na Figura 1. A partir da superfície encontrada, pode se observar que com o aumento da agitação orbital há uma diminuição de 1,75 U/mg na atividade da PO. Sendo assim, observando o ensaio 1 apresentou a maior atividade específica da enzima a 100 rpm com um volume de 15 mL. Após a otimização concluída, foi confirmada a padronização da metodologia de extração comparando outras três condições de agitação, viabilizando uma maior obtenção da enzima PO, demonstrado na Figura 2, em termos de atividade relativa (%). A Figura 2 explica que a alta força de cizalhamento dos agentes extratores ultrassom e blender, pode levar a desnaturação da enzima de interesse. Com a quebra da parede celular por essas forças, há a liberação de compostos fenólicos que oxidados por enzimas na presença de oxigênio molecular levam a inativação de muitas outras enzimas[9]
Figura 2: Efeito das diferentes extrações sobre a atividade da PO de F
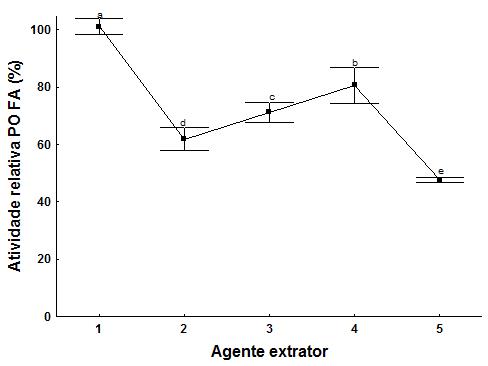
Figura 1: Superfície de resposta gerada através do planejamento experi

CONCLUSÕES: Com isso, podemos observar que quanto mais abrasivo é o agente utilizado para extração, menor é a atividade e a quantidade da PO obtida, onde a redução é maior que 50% quando comparando o uso de agitação orbital com blender. Portanto, a melhor extração para a enzima PO de FA é observada por agitação orbital a 100 rpm durante 60 min, utilizando 15 mL de solvente extrator para 5 g de amostra, com uma atividade específica de 28,74 U/mg e uma atividade de 1071,26 U/g.
AGRADECIMENTOS: Laboratório de Micotoxinas e Ciência de Alimentos, CAPES, CNPQ, Programa de pós-graduação em Química Tecnológica e Ambiental e a FURG.
REFERÊNCIAS BIBLIOGRÁFICA: (1) MAPA. Ministério da Agricultura, Pecuária e Abastecimento, Brasil Projeções do Agronegócio 2010/2011 a 2020/2021- Assessoria de Gestão Estratégica. Brasília Junho de 2011. Disponível em: http://www.agricultura.gov.br/arq_editor/file/Ministerio/gestao/projecao/PROJECOES%20DO%20AGRONEGOCIO%202010-11%20a%202020-21%20-%202_0.pdf Acesso em: 15 de outubro de 2011.
(2) KHAN, S. H.; BUTT, M. S.; SHARIF, M. K.; SAMEEN, A.; MUMTAZ, S.; SULTAN, M. T. Functional properties of protein isolates extracted from stabilized rice bran by microwave, dry heat, and parboiling. Journal of Agricultural and Food Chemistry, v. 59, p. 2416–2420, 2011.
(3) CAO, X.; WEN, H.; LI, C.; GU, Z. Differences in functional properties and biochemical characteristics of congenic rice proteins. Journal of Cereal Science. v. 50, p. 184-189, 2009.
(4) INDINANI, C.; FEIS, A.; HOWES, B. D.; MARZOCCHI, M. P.; SMULEVICH, G. Effect of low temperature on soybean peroxidase: spectroscopic characterization of the quantum-mechanically admixed spin state. Journal of Inorganic Biochemistry. v. 79, p. 269–274, 2000.
(5) BON, E. P. S.; FERRARA, M. A.; CORVO, M. L. Enzimas em Biotecnologia: Produção, Aplicações e Mercado. Rio de Janeiro: Interciência Brasil, p. 506, 2008.
(6) CARDINALI, A.; TURSI, N.; LIGORIO, A.; GIUFFRIDA, M. G.; NAPOLITANO, L.; CALIANDRO, R.; SERGIO, L.; VENERE, D. D.; LATTANZIO, V.; SONNANTE, G. Purification, biochemical characterization and cloning of a new cationic peroxidase isoenzyme from artichoke. Plant Physiology and Biochemistry, v. 49, P. 395-403, 2011.
(7) LOWRY, O. H.; ROSENBROUGH, M. J.; FARR, A. L.; RANDALL, R. J. Protein measurement with the folin phenol reagent. Journal of Biological Chemistry, v. 193, p.265-275, 1951.
(8) DEVAIAH, S. P.; SHETTY, H. S. Purification of an infection-related acidic peroxidase from pearl millet seedlings. Pesticide Biochemistry and Physiology, v. 94, p. 119-126, 2009.
(9) COELHO, M. A.; SALGADO, A. M.; RIBEIRO, B. D. Tecnologia Enzimática, Editora EPUB, Brasil, 2008.
