Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Bioquímica e Biotecnologia
TÍTULO: CARACTERIZAÇÃO DAS ESFERAS DE QUITOSANA
AUTORES: Maria Batista Chagas, P. (UFLA) ; Esteves Nogueira, G. (USP) ; Arriel Torres, J. (UFLA) ; Cristina Silva, M. (CEFET) ; Correa Duarte, A. (UFLA)
RESUMO: A fixação ou encerramento das enzimas em suportes sólidos proporciona diversas
vantagens sobre as enzimas livres. Consequentemente, muitos suportes têm sido
utilizados para a imobilização de enzimas de interesse, entre estes destaca-se a
quitosana, que possuiu várias propriedades físicas, químicas e biológicas que a
tornam muito versátil quimicamente, sendo considerada um suporte ideal para
imobilização de enzimas. neste trabalho, caracterizou-se o pó e as esferas de
quitosana quanto ao grau de desacetilação (GD), bem como a análise estrutural dos
materiais por microscopia eletrônica de varredura (MEV) e difração de Raios X
(DRX) para posterior uso deste material na imobilização de enzimas.
PALAVRAS CHAVES: Imobilização; enzima; quitosana
INTRODUÇÃO: As enzimas apresentam várias propriedades que as tornam atrativas como
catalisadores para biotransformações. Um grande número de enzimas, provenientes
de uma variedade de vegetais e microrganismos, vem sendo apresentadas como capaz
de desempenhar importantes papéis em diferentes aplicações nas indústrias
alimentícia, têxtil, de papel e na agricultura, resultando em significativas
reduções de custos (CARDOSO et al., 2009).
Em reações químicas e bioquímicas, o uso de enzimas puras pode ser dispendioso e
seu descarte após o uso é economicamente inviável. Além disso, muitas enzimas
não são suficientemente estáveis dentro das condições operacionais, e elas podem
perder a atividade catalítica.
O desenvolvimento de técnicas de imobilização tem sido importante por
proporcionar a reutilização das enzimas, facilitar a separação dos produtos e
aumentar a estabilidade em solventes orgânicos (DALLA-VECCHIA et al., 2004). A
utilização de formas enzimáticas imobilizadas é de fundamental importância para
aumentar a potencialidade dos sistemas enzimáticos no tratamento de resíduos
industriais. Consequentemente, muitos suportes têm sido utilizados para a
imobilização de enzimas de interesse, entre estes destaca-se a quitosana, que
possuiu várias propriedades físicas, químicas e biológicas que a tornam muito
versátil quimicamente, sendo considerada um suporte ideal para imobilização de
enzimas.
Dentro deste contexto, objetivou-se neste trabalho, caracterizar o pó e as
esferas de quitosana quanto ao grau de desacetilação (GD), bem como a análise
estrutural dos materiais por microscopia eletrônica de varredura (MEV) e
difração de Raios X (DRX) para posterior uso deste material na imobilização de
enzimas.
MATERIAL E MÉTODOS: Obtenção das esferas de quitosana
Amostras contendo 1,5 g de quitosana foram diluídas em 40 mL de solução de ácido
acético 2% (m/v). A solução obtida foi gotejada sobre solução de hidróxido de
sódio 2,0 mol L-1, o que provoca imediatamente a coagulação do gel em formato
esférico (3). As esferas foram divididas em duas porções e submetidas aos
tratamentos: a) a 1a porção das esferas foi reticulada (ativada) com
glutaraldeído 2,5% e secas à temperatura ambiente e b) a 2a porção foi seca à
temperatura ambiente (sem reticulação).
Determinação do grau de desacetilação da quitosana
A percentagem GD do pó da quitosana, das esferas reticuladas e não reticuladas
foi determinada por titulação potenciométrica (BROUSSIGNAC, 1972). 20,0 mL de
solução de ácido clorídrico 0,1 mol L-1 foram adicionados em 0,2 g de pó de
quitosana e também em 0,2 g das esferas. Em seguida, as soluções foram tituladas
com hidróxido de sódio 0,1 mol L-1 até o volume final de 25 mL, com adições de
0,2 mL de titulante a cada medida.
Análise das esferas por microscopia eletrônica de varredura
As micrografias foram obtidas em um equipamento ZEISS LEO 440 (Cambridge,
England) com detector OXFORD, operando com feixe de elétrons de 15kV.
Análise de difração de Raios X
Os materiais foram caracterizados por DRX, utilizando um difratômetro de raios X
da Rigaku Geigerflex, equipado com um monocromador de grafite e radiação CuKα
(= 1,5406 Å), a corrente de 30 mA e tensão de 45 kV. A velocidade de varredura
utilizada foi de 2° min-1, usando a contagem de tempo de cinco segundos por
incremento e empregando-se uma variação angular de 5 a 50°.
RESULTADOS E DISCUSSÃO: O GD médio é definido como o número de grupos amino em relação aos grupos amida
da cadeia polimérica (RAYMOND, 1993. O GD calculado no pó de quitosana e nas
esferas sem a reticulação foi de 77,02% e 80,7%. As esferas reticuladas com
glutaraldeído não apresentaram quantidade de grupos amino protonáveis
mensuráveis pelo método. Este resultado sugere que a ligação do glutaraldeído
ocorreu pelos grupos amino da quitosana. Os resultados
obtidos por MEV mostraram a formação de pequenos grânulos com tamanhos
irregulares para o pó de quitosana (Figura 1a). Após o procedimento para
obtenção das esferas de quitosana (Figura 1b e 1c), nota-se que a esfera sem o
tratamento com glutaraldeído (Figura 1b) apresentou rugosidades na sua
superfície, enquanto que na esfera reticulada com glutaraldeído houve uma
alteração significativa na superfície tornando-a mais uniforme. Constatou-se,
contudo, que a
reticulação não gerou poros na superfície, preservando praticamente as dimensões
originais das esferas antes da reticulação .A estrutura cristalina dos materiais
foi estudada por difratometria de raios X. Todos os materiais apresentaram
picos de difração em 2θ = 20o referentes a quitosana (Figura 2). Na Figura 2a e
2b, além do pico em 2θ = 20o observou-se um halo de difração em 2θ =10o também
referente a quitosana. Segundo Uragami (2006), as fortes interações intra e
intermolecular devido as ligações de hidrogênio entre os grupos amina, álcool e
amida presentes na molécula de quitosana, faz com que esse material apresente
certa cristalinidade. Na Figura 3c observou-se o completo desaparecimento do
pico de difração em 2θ =10o bem como uma diminuição significativa na
cristalinidade do material após a ativação com glutaraldeído.
Figura 1

Micrografias do pó de quitosana (a); esfera sem
reticulação (b); esfera reticulada com glutaraldeído
2,5 % (c)
Figura 2
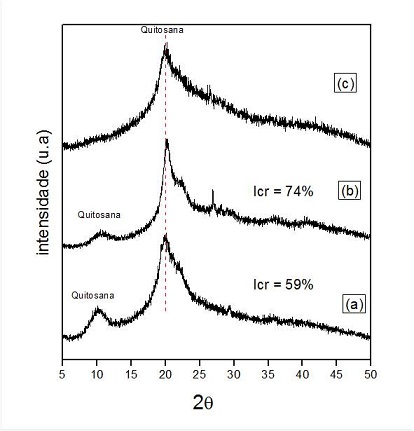
DRX do pó de quitosana (a) esferas de quitosana sem
reticulação (b) e esferas reticuladas com
glutaraldeído (c)
CONCLUSÕES: Os resultados das análises realizadas neste trabalho apresentaram características
importantes sobre a estrutura da quitosana que será utilizada como suporte na
imobilização de enzimas.
AGRADECIMENTOS: Capes, Cnpq, FAPEMIG
REFERÊNCIAS BIBLIOGRÁFICA: BROUSSIGNAC, J. Un hault polymere natural per connum dans I’industrie le chitosan, Chimie et Industrie-Genie Chimique, Paris, v.99, p.1241-1249, 1972.
CARDOSO et al. Imobilização de enzimas em suportes cromatográficos: uma ferramenta na busca por substâncias bioativas. Química Nova, São Paulo, v.32, n.1, p. 175-187, 2009.
DALLA-VECCHIA, R.; NASCIMENTO, M. G.; SOLDI, V. Aplicação de lipases imobilizadas em polímeros. Química Nova, v.27, n. 4, p. 623-630, 2004.
RAYMOND, L.; MORIN, F. G.; MARCHESSAULT, R. H. Degree of deacetylation of chitosan using conductometric titration and solid-state NMR. Carbohydrate Research v. 246, p. 331 – 336, 1993.
URAGAMI T.; TOKURA S., (eds.) Material Science of Chitin and Chitosan, Japan: Kodansha Ltd., Springer, 2006.
