Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Bioquímica e Biotecnologia
TÍTULO: AVALIAÇÃO DA ATIVIDADE BACTERICIDA DA LECTINA DE Croton campestris.
AUTORES: Silva, D.G.R. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Melo, A.S. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Napoleão, T.H. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Gomes, F.S. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Coelho, L.C.B.B. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Paiva, P.M.G. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Costa, J.A. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Silva, C.D. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Cunha, M.C. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Sá, R.A. (UNIVERSIDADE FEDERAL DE PERNAMBUCO)
RESUMO: O presente trabalho refere-se ao isolamento de Lectinas (proteínas) da Croton
campestris e sua ação frente a bactérias gram-positivas e gram-negativas. As
bactérias utilizadas foram: Staphylococcus aureus; Salmonella enteritidis;
Escherichia coli e Klebsiella pneumoniae. O extrato salino foi realizado a
partir do pó das folhas de Croton campestris em solução de NaCl 0,15M. O extrato
foi fracionado com (NH4)2SO4. O precipitado foi dialisado e aplicado em
cromatografia em Coluna de Quitina recolhendo-se a lectina purificada chamada de
PII. A atividade bactericida foi avaliada através do método de COURVALIN et al
(1985). Observou-se que a maior ação inibitória de PII foi para S. enteritidis
com uma CMI de 1,95 µg/mL. Enquanto o ES apresentou CMI = 1,5mg/mL para S.
enteritidis e E. coli.
PALAVRAS CHAVES: Lectina; Velame; Bactericida
INTRODUÇÃO: O gênero Croton detém expressiva relevância econômica, alicerçada em seu
conteúdo de óleos essenciais e diversas substâncias ativas como terpenos,
flavonóides e alcalóides. As espécies desse gênero são empregadas com frequência
na medicina popular. Os estudos existentes centrados em espécies de Croton são
ainda escassos e dizem respeito às áreas de fitoquímica e farmacologia. Croton
campestris é uma planta utilizada na medicina popular, sendo conhecida como
“velame do campo”, seu uso é através do chá de suas folhas, sendo indicado para
o tratamento de Escrofulose, eczemas e sífilis e etc.
O termo lectina que significa selecionado refere-se à habilidade dessas
proteínas ligarem-se seletivamente e reversivelmente a carboidratos Muitas
hipóteses sobre o papel das lectinas foram levantadas devido à ocorrência de
lectinas em microorganismos e animais. Mas admite-se que a função primária das
lectinas seja a de reconhecimento de carboidratos. Lectinas vegetais poderiam
desempenhar importantes papéis tais como proteínas de reserva ou no mecanismo de
defesa contra microrganismos fitopatogênicos (PONCHEL & IRACHE, 1998). As
bactérias são organismos unicelulares e procariontes. Sua classificação é feita
de acordo com a constituição de sua parede celular: As Gram-positivas apresentam
polissacarídeos, ácidos teicóicos e peptideoglicanos, enquanto as Gram-negativas
apresentam peptideoglicanos, lipídeos, proteínas e lipopolissacarídeos
(TRABULSI, 2000). As Bactérias apresentam-se amplamente distribuídas na natureza
como também estão associadas a importantes doenças humanas que podem ser
atribuídas em parte à infecção. (Sá,R.A, 2008). Sendo necessária a busca por
produtos naturais eficientes no controle e tratamento destas infecções.
MATERIAL E MÉTODOS: Para a preparação do extrato salino (ES) utilizou-se uma solução de 5% (m/v) da
farinha das folhas de Croton campestris e NaCl 0,15M. A extração foi mantida em
temperatura ambiente e em repouso por 48h. A Atividade Hemaglutinante (AH) foi
realizada segundo a metodologia (adaptada) descrita por DERÓN DE LA BARCA, OCHOA
E VALENCIA (1985), usando placa de microtitulação contendo em cada poço 50μl do
líquido extrator, 50μl do extrato salino (ES) seguido de incubação com 50μl de
eritrócitos de coelho tratados com glutaraldeído, a placa foi mantida em repouso
durante 45 minutos, sendo lida visualmente após o término da incubação. A
precipitação proteica foi de acordo com a técnica de Green & Hughes (1995)
obtendo-se a melhor fração proteica (F2) com uma saturação de 20-40% de Sulfato
de Amônio.
A quantificação proteica foi realizada de acordo com Lowry et al. A
cromatografia em coluna de quitina foi empacotada com 10mL de quitina e
equilibrada com NaCl 0,15M. Uma alíquota de 2,0 mL de F2 foi aplicada à coluna
cromatográfica, eluída com NaCl 0,15M até a obtenção de uma absorbância menor
que 0,05, O pico proteico eluído com ácido acético contendo AH foi definido como
a lectina (PII) de Croton campestris. As soluções de PII foram dialisadas em
NaCl 0,15M. A avaliação de atividade antibacteriana foi realizada pelo ensaio de
diluição seriada segundo COURVALIN et al (1985). Alíquotas do ES e PII foram
diluídas em caldo nutriente (CN) e em seguida foram realizadas dez diluições
sucessivas. Uma alíquota de cada diluição foi transferida para os poços de uma
microplaca e posteriormente acrescidos com a suspensão bacteriana em CN (20μL,
105- 106 UFC. mL-1). Após incubação (24h a 37 ºC) a densidade ótica a 490 nm foi
medida utilizando leitor de ELISA.
RESULTADOS E DISCUSSÃO: Foi observado que o melhor método de extração da lectina de Croton campestris é
sob repouso, método também usado por Santana (2004) no isolamento de lectinas da
Macrotyloma axillare. Observou-se que a fração proteica (F2) foi purificada
através da cromatografia de afinidade em colunas de quitina. ES e F2 aglutinaram
eritrócitos de todos os tipos sanguíneos do sistema ABO, assim como eritrócitos
glutarizados de coelho.Os ensaios bactericidas revelam que a atividade do ES e
Lectina (PII), apresentaram efeito antibacteriano sobre todas as bactérias
testadas, A Condição mínima inibitória (CMI) correspondeu a menor concentração
de lectina capaz de inibir o crescimento visível do microrganismo. Os valores da
Condição Mínima Inibitória estão agrupados na Figura 2.Observou-se que com 1
mg/mL de PII atingiu-se a CMI para a S. aureus. Com 0,5 mg/mL de Lectina ocorre
a inibição da E.coli e K. pneumoniae e com 1,95 µg/mL atinge-se a inibição da S.
enteritidis.
A ação tóxica das lectinas com atividades bactericidas tem sido relacionada à
ligação dessas proteínas através de interações di-sulfetos e ligações de
hidrogênio a glicoproteínas ou carboidratos presentes nas paredes celulares dos
microorganismos.
Figura 1
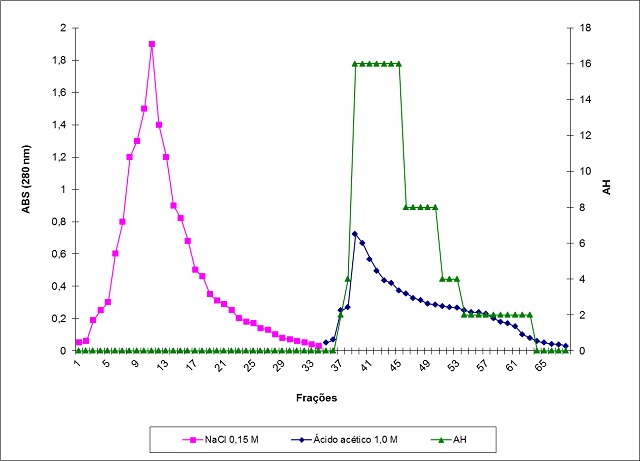
Cromatografia de F2 (6,0 mg) em coluna de quitina. O
suporte foi equilibrado com NaCl 0,15 M. PII
(lectina) foi obtida através de eluição com C2H4O2
Figura 2
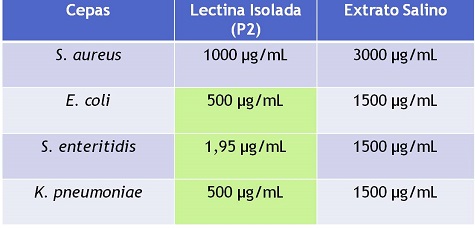
Condições Mínimas Inibitórias (CMI) para Extrato
Salino e lectina de Croton Campestris.
CONCLUSÕES: ES e a PII aglutinaram eritrócitos de todos os tipos sanguíneos do sistema ABO,
assim como eritrócitos glutarizados de coelho. A cromatografia em coluna de
quitina purificou satisfatoriamente a fração proteica.
O ES e PII apresentaram efeito bactericida sobre todas as bactérias testadas. O
Extrato Salino apresentou uma CMI = 1,5mg/mL para E.coli, S. enteritidis e
K.pneumoniae. Já a maior ação inibitória da PII foi para S. enteritidis com uma
CMI = 1,95 µg/mL. A ação inibitória da também foi obtida de maneira satisfatória
para a E.coli e para a K.pneumoniae com uma CMI = 0,5 mg/mL
AGRADECIMENTOS: A FACEPE pelo apoio financeiro.
Ao Departamento de Bioquímica da Universidade Federal de Pernambuco.
Ao Laboratório de Química da UFPE-Campus Agreste.
REFERÊNCIAS BIBLIOGRÁFICA: LOWRY, O.H. et al. Protein measurement with the Folin phenol reagent. Journal of Biological Chemistry 193, 265–275, 1951.
PONCHEL, G.; IRACHE, J. M. Specific and non-specific bioadhesive particulate systems for oral delivery to the gastrointestinal tract. Advanced Drug Delivery Reviews 34: 191-219, 1998.
Sá,R.A, Constituintes químicos da madeira-de-lei Myracrodruon urundeuva com propriedades antioxidantes e ação contra Fungos, Bactérias e Insetos - Recife , Universidade Federal de Pernambuco,CCEN, Química Fundamental, 2008.
SANTANA, M. A. Isolamento, Propriedades bioquímicas e estudos biológicos da Lectina de semente da Macrotyloma axillare (E. Meyer.), Ouro Preto, Universidade federal de Ouro Preto, Centro de ciências exatas e biológicas, 2004.
TRABULSI, R. Microbiologia. 3a. ed. Rio de Janeiro: Guanabara-Koogan, 2000.
