Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Alimentos
TÍTULO: Quantificação de ácidos fenólicos e metilxantinas em algaroba (Prosopis juliflora) processada como sucedâneo do café por CLAE-DAD
AUTORES: Lima, E.R.N. (UESB) ; Santos, L.A. (UESB) ; Silva, N.M.C. (IFBAIANO) ; Pereira, L.C.L. (UESB) ; Oliveira, C.P. (UESB) ; Simionato, J.I. (UTFPR) ; Lima, M.D. (UESB) ; Santana, D.A. (UESB)
RESUMO: A algaroba (Prosopis juliflora) é utilizada como substituto do café após processo
de torra e moagem em regiões semiáridas do nordeste brasileiro. Visando um
aproventamento tecnológico da algarobeira, foi realizado o preparo de um
sucedâneo de café com o uso das vagens da algaroba e realizada a identificação e
quantificação os ácidos cafeíco, ferúlico, teobromina e cafeína por CLAE-DAD em
amostras de algaroba processada como sucedâneo de café
PALAVRAS CHAVES: polifenóis; cafeína; teobromina
INTRODUÇÃO: A cromatografia líquida de alta eficiência (CLAE) é uma das técnicas analíticas
de separação mais usadas. Esse método possui elevada detectabilidade, a
adaptabilidade às determinações quantitativas com exatidão, a adequação para a
separação de compostos não-voláteis ou termicamente instáveis e sua ampla
aplicação a substâncias de grande interesse para a indústria, para muitos campos
da ciência e para o público. (HOLLER et al., 2009).
Os ácidos fenólicos são derivados hidroxilados do ácido benzóico ou do ácido
cinâmico. Nos últimos anos eles têm recebido particular atenção devido às suas
propriedades antioxidantes, por seu papel na prevenção de diversas doenças,
particularmente aterosclerose e câncer e por proteger a pele contra o eritema
induzido por radiação UVB (YAMADA et al., 2006). As metilxantinas são utilizadas
em preparações caseiras ou para elaborar em escala industrial bebidas
estimulantes não alcoólicas, como por exemplo, o mate e o café (PAGLIOSA, 2009).
Em relação aos efeitos na saúde as metilxantinas podem atuar como estimulantes
do sistema nervoso central e cardiorespiratório, analgésico, relaxante da
musculatura lisa entre outros (MEINHART et al., 2010; AZAM et al., 2003).
A algaroba é utilizada na alimentação humana através de farinhas e melados, em
substituição a alguns alimentos convencionais como farinha de trigo, café e
rapadura (RIBASKI et al., 2009). Desde a antiguidade os frutos da algaroba já
eram torrados, macerados e utilizados em pó, como substituto do café na América
Latina, e é muito aplicado para o mesmo fim em regiões semi-áridas do nordeste
brasileiro (VIEIRA et al., 1995)
O objetivo deste trabalho foi quantificar compostos fenólicos identificados na
algaroba por meio de cromatografia líquida de alta eficiência (CLAE)
MATERIAL E MÉTODOS: As análises cromatográficas foram realizadas em um cromatógrafo líquido de alta
eficiência Shimadzu, com sistema quaternário de solventes, válvula de injeção
com alça de amostragem de 20µL, forno de coluna e detector de arranjo de diodos.
As separações foram realizadas empregando-se uma coluna C18 Thermo Hypersil ODS
(4,6 x 150mm, 5µm). Com gradiente linear iniciando 10:90 H2O/ácido acético
(97,5:2,5 % v/v) (A) e de MeOH (B) e 0 a 5’ – 50% B; 7’ – 65% B; 10’ – 65% B;
12’ – 10% B vazão: 1,3 mL/min.
A solução de extração foi preparada utilizando MeOH/H2O (10:90 v/v) com 5% de
ácido acético. As amostras foram pesadas (0,50 g), extraídas com 30 mL das
soluções e aquecidas a 80 ºC por 10 minutos. Estas foram filtradas em balão de
50 mL com papel de filtro qualitativo completando-se o volume com a solução de
extração. O extrato final foi filtrado em filtro de seringa e injetado no
cromatográfico (Alves et al. 2006).
Para construção da curva analítica, preparou-se soluções dos padrões, na
concentração de 1000,0 mg L-1, dissolvendo-se a os padrões em acetonitrila.
Posteriormente foi preparada uma solução intermediária em metanol contendo todos
os padrões na concentração de 100,0 mg L-1 de onde foram retiradas alíquotas
para o preparo das soluções que compunham a curva cujas concentrações foram de
1,0; 5,0; 10,0; 15,0; 20,0 e 25,0 mg L-1. A curva analítica foi construída
correlacionando-se os valores médios das áreas de 3 medidas para cada ponto da
curva em função da concentração. E os LD e LQ foram calculados baseado em
parâmetros da curva analítica através dos parâmetros gerados pelo software
Microsoft Excel® aplicando as equações: LD= 2 x S/a e LQ= 6 x S/a onde S =
desvio-padrão da resposta; a = o coeficiente angular do gráfico de calibração
(sensibilidade do aparelho).
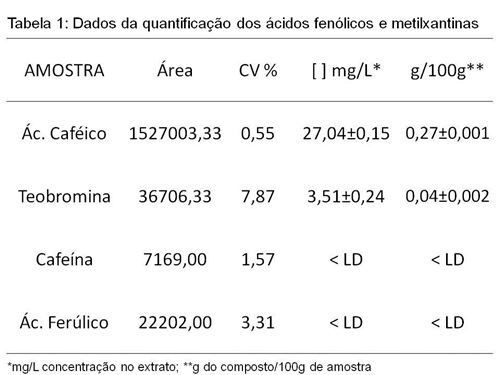
RESULTADOS E DISCUSSÃO: A análise cromatográfica da amostra de algaroba permitiu por comparação dos
tempos de retenção dos padrões injetados e tentativamente identificar a presença
de ácido caféico, ácido ferúlico, teobromina cafeína, mostrada na figura 1.
Os resultados de LD para o ácido caféico, ácido ferúlico, teobromina cafeína
foram 1,40; 0,77; 0,51; 0,50, para o LQ obteve-se 4,22; 2,33; 1,52; 1,51 mg L-1
respectivamente.
Não existem relatos dos ácidos fenólicos estudados neste trabalho em café, no
entanto eles são precursores dos ácidos clorogênicos muito explorados nesse tipo
de matriz (Moreira, 2000). Na algaroba, apenas o ácido caféico foi quantificação
já que as quantidades do ácido ferúlico foram inferiores ao limite de detecção.
O teor de cafeína em cafés são bem explorados Monteiro e Trugo, estudando dez
amostras de café comerciais do Brasil encontraram variação de 0,8 a 1,4 g 100 g-
1. Já a presença da teobromina no café é muito pequena, no entanto para as
amostra de algaroba percebe-se o contrário, já que a quantidade de cafeína foi
inferior ao limite de detecção enquanto que a teobromina foi quantificável nesta
amostra.

CONCLUSÕES: Pode-se concluir que a algaroba é um bom substituto do café quando se objetiva a
não ingestão de cafeína, além de ter o ácido caféico que atua como antioxidante
promovendo os benefícios que essa classe promove.
AGRADECIMENTOS: UESB
REFERÊNCIAS BIBLIOGRÁFICA: ALVES, S.T.; DIAS, R.C.E.; BENASSI, M.T. Metodologia para análise simultânea de ácido nicotínico, trigonelina, ácido clorogênico e cafeína em café torrado por cromatografia líquida de alta eficiência. Química Nova, v.29, n6, 1164-1168, 2006.
AZAM, S.; HADI, N.; KHAN, N.U.; HADI, S.M. Antioxidant and pro oxidant properties of caffeine, theobromine and xanthine. Medicinal Science Monitor. v: 9: 325-30, 2003.
HOLLER, F.J.; SKOOG, D.A.; CROUCH, S.R. et al. Princípios de Análise Intrumental. 6 ed. Porto Alegre: Bookman, 2009.
MATTILA, P., KUMPULAINEN, J. Determination of free and total phenolic acids in plant-derived foods by CLAE with diode-array detection. J. Agric. Food Chem., v.50, p.3660-3667, 2002.
MEINHART, A.D.; BIZZOTTO, C.S.; BALLUS, C.A.; POLONI RYBKA,A.C.; SOBRINHO, M.R.; CERRO-QUINTANA, R.S.; TEIXEIRA-FILHO, J.;GODOY, H.T. Methylxanthines and phenolics content extracted during the consumption of mate (Ilex paraguariensis St. Hil) beverages. Journal of Agricultural and Food Chemistry. v:24; 58(4), 2188-2193, 2010.
MONTEIRO, M.C.; TRUGO, L.C. Determinação de compostos bioativos em amostras comerciais de café torrado. Química Nova, v.28, n.4, 637-641, 2005.
MOREIRA, R.F.A; TRUGO, L.C. Componentes voláteis do café torrado. Parte II. Compostos alifáticos alicíclicos e aromáticos. Química Nova, v.23, n.2, 195-203, 2000.
PAGLIOSA, C.M. Caracterização química do resíduo de ervais e folhas “in natura” de erva-mate (Ilex paraguariensis A. St. Hil.). 2009, 446f. Dissertação de Mestrado em Ciências dos Alimentos - Centro de Ciências Agrárias, Universidade Federal de Santa Catarina.Florianópolis, 2009.
RIBASKI, J.; DRUMOND, M.A.; OLIVEIRA, V.R.; NASCIMENTO, C.E.S. Algaroba (Prosopis juliflora): Árvore de Uso Múltiplo para a Região Semiárida Brasileira. Comunicado Técnico 240. ISSN 1517-5030, 2009.
VIEIRA, R. L.; GUERRA, N.B.; FREITAS, E.M. Sucedâneo de café a partir de Prosopis juliflora D.C. Pesquisa Agropecuária Brasileira. v.30, n.1, 1995.
YAMADA, Y.; YASUI, H.; SAKURAI, H. Suppressive Effect of Caffeic Acid and its Derivatives on the Generation of UVA-induced Reactive Oxygen Species in the Skin of Hairless Mice and Pharmacokinetic Analysis on Organ Distribution of Caffeic Acid in ddY Mice. Photochem. Photobiol., v.82, n.6, p. 1668-1676, 2006.
