Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Química Orgânica
TÍTULO: Síntese e avaliação da atividade anticolinesterásica de azinas assimétricas
AUTORES: Silva, K.P. (UNIVERSIDADE ESTADUAL DE GOIAS) ; Aquino, G.L.B. (UNIVERSIDADE ESTADUAL DE GOIAS) ; Queiroz, J.E. (UNIVERSIDADE ESTADUAL DE GOIAS) ; Safadi, G.M.V.V. (UNIVERSIDADE ESTADUAL DE GOIAS) ; Figueredo, A.S. (UNIVERSIDADE ESTADUAL DE GOIAS)
RESUMO: A doença de Alzheimer constitui a forma mais comum de demência em idosos e se
caracteriza por perda de memoria e capacidades motoras. Os tratamentos
existentes são apenas sintomáticos e os medicamentos utilizados elevam os níveis
de acetilcolina pela inibição da enzima acetilcolinesterase (AChE). Contudo, sua
ação nem sempre é bem sucedida, justificando a busca por inibidores mais
potentes e menos tóxicos. Para tanto, várias classes de compostos tem sido
estudadas. O objetivo desse estudo foi avaliar, in vitro, a atividade
anticolinesterásica de uma série de azinas assimétricas derivadas de aril-
aldeídos e aril-cetonas utilizando ensaio em microplaca com o reagente de
Ellman. Dentre os compostos testados, 5 apresentaram capacidade de inibir a
AChE, com percentuais de 0,5 a 18,34%.
PALAVRAS CHAVES: Doença de Alzheimer; Anticolinesterásicos; Azinas
INTRODUÇÃO: A doença de Alzheimer é uma desordem neurodegenerativa caracterizada por perda
irreversível e progressiva da memória e das funções cognitivas. Embora a
etiologia da doença não seja bem determinada, acredita-se que a combinação de
várias alterações cerebrais contribua para o seu desenvolvimento, com destaque
para a diminuição dos níveis de acetilcolina (ACh)(ALZHEIMER’S ASSOCIATION,
2010).
Baseados na hipótese colinérgica como causa principal dos sintomas, os
medicamentos modernos atuam elevando os níveis desse neurotransmissor pela
inibição da enzima acetilcolinesterase. Atualmente, cinco fármacos são aprovados
pelo FDA, sendo quatro inibidores da AChE: Tacrina, Donepezil, Rivastigmina e
Galantamina.
Todavia o sucesso de tais fármacos é limitado, pois estas drogas apenas retardam
o progresso da doença, mas não podem parar a neurodegeneração e praticamente são
ineficientes em estágios avançados da doença de Alzheimer. Além disso, alto
custo e efeitos colaterais severos dificultam a adesão ao tratamento (FINDEIS,
2007).
Na busca por novos inibidores várias classes de compostos tem tido seu potencial
anticolinesterásico avaliado. A proposta deste foi determinar a capacidade de
inibição da AChE por uma série de azinas assimétricas derivadas de aril-aldeídos
e aril-cetonas.
As azinas ou bis hidrazonas são compostos que contém o grupo azometino (C=N–
N=CH) em sua estrutura, sendo sintetizadas, geralmente, pela reação entre uma
amina primária e grupos carbonila de aldeídos e cetonas. Além de importantes
intermediários na síntese de medicamentos e compostos diversos, suas aplicações
biológicas conhecidas incluem, entre outras, atividade anticonvulsivante,
antiparasitária, analgésica, anti-inflamatória e antitumoral (ROLLAS, 2007).
MATERIAL E MÉTODOS: A capacidade de inibição de 15 azinas assimétricas sobre a acetilcolinesterase
foi avaliada in vitro pelo método de Ellman (RHEE et al., 1961) modificado por
Rhee e colaboradores, 2001 (RHEE et al., 2001).
Os testes foram realizados em microplacas de 96 poços, com leitor automático.
Nas microplacas foram adicionados 25 μL de iodeto de acetiltiocolina 15 mMol em
água, 125 μL de 5,5'-ditio-bis-2-nitrobenzóico (DTNB) 3 mMol em tampão Tris A pH
8, 50 μL de tampão B pH 8 contendo 0,1% de soro de albumina bovina e 25 μL da
solução de amostra, 1 mmol em metanol.
A absorvância foi monitorada a cada 10 s durante 230s em 412 nm. Após esse
período 25 μL de uma solução aquosa de enzima AChE 0,226 U/ml foram adicionados
e a absorvância novamente monitorada a cada 10 s durante 230 s em 412 nm. Como
controle positivo foi utilizado fisostigmina (eserine).
A atividade enzimática foi calculada, em porcentagem, pela comparação entre as
velocidades das reações nos poços com amostras e a velocidade do ensaio usando
tampão sem qualquer inibidor. O cálculo foi feito conforme expressão a seguir:
I%= V(enzima s/ amostras) - V(enzima c/ amostras)
V (enzima sem amostras)
Qualquer aumento da absorvância antes da adição da enzima devido à hidrólise
espontânea do substrato foi corretamente corrigido subtraindo-se a taxa da
reação antes da adição da enzima da taxa obtida após a adição da enzima. As
amostras foram analisadas em triplicata e os resultados apresentados neste
estudo correspondem à média de três repetições (n=3) ± desvio padrão da média.
RESULTADOS E DISCUSSÃO: Foram avaliadas 15 azinas assimétricas, cuja estrutura básica é apresentada na
figura a seguir (fig1).
Dessas, 5 apresentaram capacidade de inibir a enzima in vitro. As análises foram
realizadas em concentrações de 10 a 100 µmol, utilizando mistura
diclorometano/metanol como solvente. Os compostos que apresentaram atividade,
assim como os percentuais de inibição estão apresentados na figura 2 (fig2).
Analisando a influência dos fatores estruturais foi possível observar que os
compostos 6 (18, 24%) e 10 (17,43%), que não têm substituintes no primeiro anel,
apresentaram os maiores valores de inibição. O composto 15, com radical
dimetilamino na posição 4, apresentou percentual de inibição de 15,56%.
Já os compostos 1 e 14 apresentaram percentuais de 0,5 e 2,99% o que os
classifica como possíveis falsos positivos (ORHAN et al., 2007).
De forma geral, esses resultados permitem sugerir também que a presença de
metila na posição R1 foi importante para atividade.
É preciso considerar ainda que os testes foram limitados pela baixa solubilidade
dos compostos em água, o que não permitiu que as análises fossem realizadas em
concentrações maiores.
Figura 1
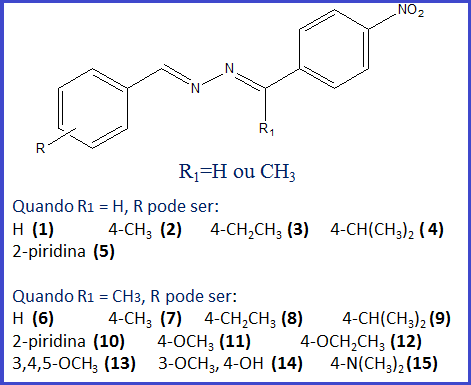
Estrutura de azinas sintetizadas por reação em
microondas entre benzaldeídos/acetofenonas e hidrato
de hidrazina (solução 70%).
Figura 2
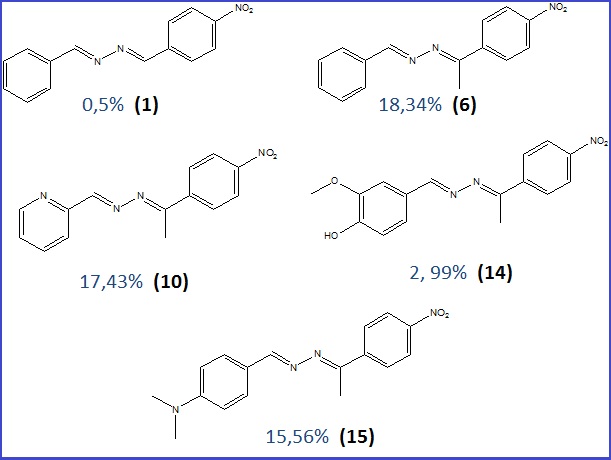
Compostos que apresentaram atividade
anticolinesterásica e os respectivos percentuais de
inibição.
CONCLUSÕES: A atividade anticolinesterásica das azinas foi avaliada in vitro pelo método de
Ellman modificado por Rhee. Este se mostrou eficiente, permitindo testar um bom
numero de substancias de forma rápida e reprodutível. Dos compostos avaliados, 5
foram capazes de inibir a enzima, com destaque para 2, 4 e 5 (fig.1). Esses
resultados devem levar em consideração ainda a baixa solubilidade dos compostos em
água, que só permitiu ensaios em baixas concentrações. Concluir sobre o potencial
terapêutico das amostras depende ainda de novas análises como a determinação dos
valores de IC50 e biodisponibilidade.
AGRADECIMENTOS: À Coordenação de Aperfeiçoamento Pessoal de Nível Superior (CAPES)e à Universidade
Federal do Paraná (UFPR).
REFERÊNCIAS BIBLIOGRÁFICA: ALZHEIMER’S ASSOCIATION. Alzheimer’s Disease Facts and Figures. 2010, Alzheimer’s & Dementia, 6: 158-194.
FINDEIS M. A. The role of amyloid β peptide 42 in Alzheimer's disease. 2007, Pharmacology & Therapeutics, 116:266–286.
ROLLAS, S, KÜÇÜKGÜZEL, S. G. Biological Activities of Hydrazone Derivatives. 2007, Molecules, 12: 1910-1939.
ELLMAN GL, COURTNEY K. D, ANDRES V, FEATHERSTONE R. M. A new and rapid colorimetric determination of acetylcholinesterase activity. 1961, Biochem Pharmacol, 7: 88-95.
RHEE I. K, VAN DE MEENT M, INGKANINAN K, VERPOORTE R. Screening for acetylcholinesterase inhibitors from Amaryllidaceae using silica gel thin-layer chromatography in combination with bioactivity staining. 2001, J Chromatogr A, 915: 217-223.
ORHAN, I, NAZ, Q, KARTAL, M, TOSUN, F, SENER, B, CHOUDHARY M. I. In vitro anticholinesterase activity of various alkaloids. Z Naturforsch v.62, p.684-688, 2007.
