ÁREA: Nanociência e Nanotecnologia
TÍTULO: INCORPORAÇÃO DE ÁCIDOS FENÓLICOS DE Spirulina sp. EM MEMBRANAS LIPÍDICAS
AUTORES: Pagnussatt, F.A. (FURG) ; de Lima, V.R. (FURG) ; Filoda, P.F. (FURG) ; Darley, F.T. (FURG) ; Garda-buffon, J. (FURG) ; Badiale-furlong, E. (FURG)
RESUMO: Neste trabalho foi testado o efeito de um extrato fenólico de Spirulina sp. em
lipossomos contendo dimiristoilfosfatidilcolina (DMPC). A interação entre os
ácidos presentes no extrato fenólico e o lipossomo foi caracterizada através das
técnicas de Calorimetria de Varredura Diferencial (DSC) e Espectroscopia de
Infravermelho com Transformada de Fourier (FT-IR). A incorporação do extrato
fenólico nas membranas lipídicas parece ter alterado a dinâmica das regiões
polares e apolares dos lipossomos, influenciando a região fosfato do DMPC e
aumentando a fluidez da cauda apolar da membrana.
PALAVRAS CHAVES: lipossomos; fenóis; antifúngico natural
INTRODUÇÃO: Os ácidos fenólicos se caracterizam pela presença de anel benzênico, grupo
carboxílico e um ou mais grupos hidroxila e/ou metoxila na sua estrutura (ANGELO
e JORGE, 2007). Alguns ácidos fenólicos extraídos de Spirulina têm mostrado ação
antifúngica e a incorporação de tais ácidos em carreadores como lipossomos pode
potencializar a inibição metabólica do fungo, visto que estes sistemas podem
facilitar a interação entre os ácidos fenólicos e a membrana celular do micro-
organismo.
Os carreadores lipossomais usados para incorporação de substâncias
ativas, estão aqueles compostos por matrizes lipídicas, que permitem maior
controle da liberação do principio ativo e biocompatibilidade (FANG e BHANDAR,
2010). O tamanho das cadeias hidrocarbonetos dos lipídios que compõem os
lipossomos, bem como seu grau de insaturação, influenciam fortemente a
eficiência do encapsulamento. Em vista disto, os fosfolipídios estão entre os
lipídios mais usados para este fim, em especial a fosfatidilcolina.
O estudo do efeito dos ácidos fenólicos na dinâmica molecular dos lipossomos ao
qual foram encapsulados, comparado a sua forma livre, é fundamental para
viabilizar o uso de substâncias naturais com atividade antifúngica em sistemas
farmacológicos eficientes. Este trabalho propõe caracterizar a interação entre
ácidos fenólicos provindos de Spirulina e lipossomos contendo
dimiristoilfosfatidilcolina (DMPC) através das técnicas de Calorimetria de
Varredura Diferencial (DSC) e Espectroscopia de Infravermelho com transformada
de Fourier (FT-IR). Assim sendo, o trabalho também pretende estabelecer
condições para incorporar ácidos fenólicos extraídos de Spirulina em lipossomos
compostos por dimiristoilfosfatidilcolina (DMPC), visando aumentar a eficiência
deles como antifúngicos naturais.
MATERIAL E MÉTODOS: A Spirulina sp. LEB-18 foi cultivada na planta piloto de Santa Vitória do
Palmar/RS com água da Lagoa Mangueira e a biomassa coletada, seca e moída.
Os ácidos fenólicos totais foram extraídos com metanol, através da
metodologia proposta por Souza et al. (2010) e quantificados de acordo com o
método de Folin-Ciocalteau, empregando curva padrão de ácido gálico (4 a 50 μg
mL-1).
As vesículas multilamelares grandes (MLV), na ausência e presença do
extrato fenólico foram preparadas com DMPC, através do método de hidratação das
vesículas (HOPE, 1986; DE LIMA et al., 2010). Os ácidos fenólicos foram
incorporados ao sistema lipossomal no processo da co-solubilização dos lipídios
com solventes orgânicos. As concentrações adicionadas de compostos fenólicos nos
lipossomos foram de 134,1 μg ml-1 e 100 μg ml-1, para os ensaios de DSC e FT-IR,
respectivamente.
Os experimentos com DSC foram efetuados em uma velocidade de varredura
de 5ºC min-1 em faixa de temperatura 10-60ºC, com fluxo de nitrogênio de 50 mL
min-1. Os espectros de FT-IR foram obtidos a partir de amostras depositadas em
cristal HATR, submetidas a 45 varreduras a uma resolução de 4 cm-1, na faixa de
freqüência de 400 a 4000 cm-1.
RESULTADOS E DISCUSSÃO: O efeito do extrato fenólico no comportamento termotrópico da região hidrofóbica
de lipossomos de DMPC foi avaliado a partir da variação dos valores de entalpia
(∆H) dos lipídios, por DSC (Tabela 1). O decréscimo de 0,67 J g-1 no valor de
variação de entalpia (∆H), bem como de 1,46°C na temperatura de transição de
fase (Tm) do lipídio, em presença dos ácidos fenólicos de Spirulina, indicou um
aumento na fluidez das membranas de DMPC em relação à região hidrocarboneto da
membrana.
Tabela 1 Influência do extrato fenólico na variação da entalpia e T de transição
de fase de DMPC.
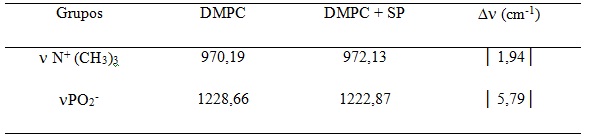
Os espectros do FT-IR demonstraram influência dos ácidos fenólicos nos
picos característicos do grupo fosfato e da colina de DMPC (Tabela 2), sugerindo
uma localização preferencial na região polar do lipídio. Os ácidos fenólicos
promoveram a diminuição do número de onda da banda correspondente ao estiramento
do grupo fosfato assimétrico lipídico (de 1228,66 a 1222,87 cm-1), decorrente do
aumento de ligações de hidrogênio entre este grupo e o composto fenólico de
Spirulina.
Tabela 2 Deslocamento das bandas na ausência e presença de extrato fenólico.
De acordo com a revisão bibliográfica realizada para este trabalho, este estudo
é pioneiro no que diz respeito ao encapsulamento de compostos fenólicos em
lipossomos preparados através do método de hidratação das vesículas.
Tabela 1
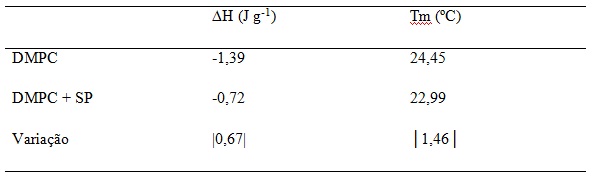
Tabela 2
CONCLUSÕES: O extrato fenólico de Spirulina pode provocar um aumento na fluidez das membranas
de DMPC. Os ácidos fenólicos, ao se localizarem na parte polar da membrana podem
estar diminuindo a comunicação entre as moléculas de lipídios, aumentando a
permeabilidade e a fluidez da membrana. Esses resultados são fatores importantes a
serem considerados em estudos para viabilização de sistemas farmacológicos usados
para inibir a multiplicação fúngica.
AGRADECIMENTOS: Rede Nanofotobiotec, Capes, FURG.
REFERÊNCIAS BIBLIOGRÁFICA: ANGELO, P. M.; JORGE, N. 2007. Compostos fenólicos em alimentos – Uma breve revisão. Revista Instituto Adolfo Lutz, 66: 1-9.
DE LIMA, V.R.; CARO, M.S.B.; MUNFORD, M.; DESBAT, B.; DUFORC, E.; PASA, A.A.; CRECZYNSKI-PASA, T.B. 2010. Influence of melatonin on the order of phosphatidylcholine-based membranes. Journal of Pineal Research 49: 169-175.
FANG, Z.; BHANDAR, Z. 2010. Encapsulation of polyphenols – a review. Trends in Food Science & Technology, 1: 510-523.
HOPE, M.J.; BALLY, M.B.; MAYER, L.D.; JANOFF, A.S.; CULLIS, P.R. Generation of multilamellar and unilamellar phospholipid vesicles. 1986. Chemical and Physical Lipids, 40: 89-107.
