ÁREA: Ensino de Química
TÍTULO: Estudo experimental do Princípio de Avogadro a partir de equipamento construído com tubos de PVC
AUTORES: Silva, J.A.D. (IFF - CAMPUS CABO FRIO) ; Santos, L.C.F. (IFF - CAMPUS CABO FRIO) ; Soares, T.R. (IFF - CAMPUS CABO FRIO) ; França, R.F. (IFF - CAMPUS CABO FRIO) ; Del Corso, V.M.G.A. (IFF - CAMPUS CABO FRIO)
RESUMO: O uso de experimentos é uma ferramenta eficaz para se trabalhar os mais diversos
conteúdos da química, dentre eles os sistemas gasosos, pois fornece aos
estudantes informações sensoriais capazes de promover um desenvolvimento
cognitivo sobre esse conteúdo. Entretanto, o elevado custo dos equipamentos
usados para estudo de sistemas gasosos inviabiliza a democratização de seu
emprego em escolas menos favorecidas financeiramente. O objetivo desse trabalho
foi o desenvolvimento de um sistema experimental de baixo custo para estudar as
relações entre as variáveis de um sistema gasoso e em especial o princípio de
Avogadro. A confecção do aparato requer tubos de PVC e seringas de plástico
facilmente encontrados no mercado e os resultados encontrados apresentam
significativa coerência científica.
PALAVRAS CHAVES: Experimentação; Sistemas gasosos; Material de baixo custo
INTRODUÇÃO: O uso de experimentos com objetivo de auxiliar e/ou promover a construção do
conhecimento em química é descrito como uma ferramenta metodológica capaz de
estimular o aprendizado do aluno na medida em que favorece a percepção de
aspectos fenomenológicos dessa ciência (FARIAS ET AL., 2009; ANDREU E RECENA,
2010). Nesse contexto vários experimentos têm sido propostos para trabalhar os
mais diversos conteúdos da química (LUZ JÚNIOR ET AL., 2004). Entretanto, alguns
conteúdos são pouco explorados por essa metodologia de ensino, dentre eles, os
sistemas gasosos. Além disso, em uma pesquisa realizada na Universidade de
Washington com mais de 1500 estudantes egressos, praticamente todos apresentaram
alguma deficiência de aprendizado no tangente a teoria do gás ideal (KAUTZ ET
AL., 1999). Uma das deficiências mais marcantes é a atribuição de diferentes
comportamentos físico-químicos a diferentes tipos de gases sujeitos às mesmas
condições, ou seja, vários estudantes acreditam que as mesmas quantidades de
gases diferentes se comportam de maneira diferente mesmo quando submetidos às
mesmas condições de pressão, temperatura e volume (KAUTZ ET AL., 1999). Este
pensamento contrapõe o conceito do princípio de Avogadro. Acredita-se que os
estudantes levam em consideração o tamanho das moléculas ao fazer a previsão do
volume ocupado pelo sistema gasoso estabelecendo uma relação proporcional entre
o tamanho das moléculas e volume por elas ocupado. O objetivo desse trabalho foi
o desenvolvimento de uma atividade experimental voltada ao estudo do princípio
de Avogadro a partir de um equipamento confeccionado com materiais de baixo
custo.
MATERIAL E MÉTODOS: A confecção do aparato requer os seguintes materiais: 1 – plataforma de madeira;
2 - tampão de PVC de 100 mm ; 3 – cano de PVC de 25 mm de diâmetro e 30 cm de
comprimento; 4 – cano de PVC de 20 mm de diâmetro e 30 cm de comprimento; 5 –
conexão de PVC 25/60 mm; 6 – conexão de PVC 20/50 mm; 7 – uma seringa de
plástico de 10 mL cuja agulha foi lacrada com parafina; 8 – uma balança de
açougueiro ou conjunto de materiais cujas massas são conhecidas, montados como
apresentado na Figura 1. Uma seringa de plástico vedada de 10 mL contendo o
mesmo volume do gás a ser estudado deve ser colocada no interior do cano 4 para
observação da variação de volume. Tanto o cano 4 quanto o 3 devem ter cortes
retangulares para visualização do volume da seringa. Após a montagem do
equipamento vários objetos de massas diversas foram adicionadas no tampão de PVC
e os valores de volume correspondentes foram registrados. Foram feitas análises
com os gases CO2, H2, O2 obtidos no laboratório
através dos seguintes métodos: CO2 – reação entre bicarbonato de
sódio e vinagre; O2 – decomposição catalítica do peróxido de
hidrogênio usando MnO2; H2 – reação entre zinco e ácido
clorídrico. Os gases assim preparados foram purificados através da passagem por
uma coluna de CaCl2 anidro e recolhidos em seringas de plástico de 10
mL prontos para as análises. Além desses também foi realizada a análise do ar
atmosférico considerado nesse experimento como N2.
RESULTADOS E DISCUSSÃO: O aparato desenvolvido é apresentado na Figura 1. Os valores de pressão foram
obtidos através das equações F = m .g e P = F / a. A partir de diversas massas
adicionadas nos sistemas foi construído o Gráfico 1 que relaciona a pressão do
sistema e seu respectivo volume. A partir da análise do gráfico pode-se observar
que o comportamento de diferentes gases quando submetidos a condições de pressão
e temperatura semelhantes possuem comportamentos de compressibilidade similares,
ou seja, em um sistema fechado contendo um volume fixo, a pressão é diretamente
proporcional à quantidade de matéria do gás independente da natureza desse gás,
conforme diz o Princípio de Avogadro. A compreensão de conceitos relacionados ao
comportamento dos gases por parte estudantes é dificultada pela necessidade de
abstração dos alunos mediante um sistema de baixa visualização macroscópica e
pelo fato de boa parte do aprendizado ser fundamentado em informações sensoriais
(BALEN E NETZ, 2005; ANDREU E RECENA, 2010). Parte dessa dificuldade está
relacionada à relutância do aluno em assumir o conceito de vazio e a necessidade
de preencher os espaços entre as moléculas em sistemas gasosos com alguma
substância somando-se a uma idéia equivocada do tamanho das moléculas em relação
ao espaço que elas ocupam (MORTIMER, 1995). Resulta desse experimento que, em
sistemas gasosos, o volume molecular não influencia significativamente no volume
do sistema à pressões ordinárias e que, por sua vez, gera um ponto de partida
para uma discussão didática acerca da teoria cinético-molecular dos gases. Desta
forma, pretende-se gerar um conflito cognitivo que substanciará uma alteração
conceitual nos estudantes.
Figura 1

Aparato desenvolvido com tubos de PVC e seringa de
plásico para o estudo de sistemas gasosos.
Gráfico 1
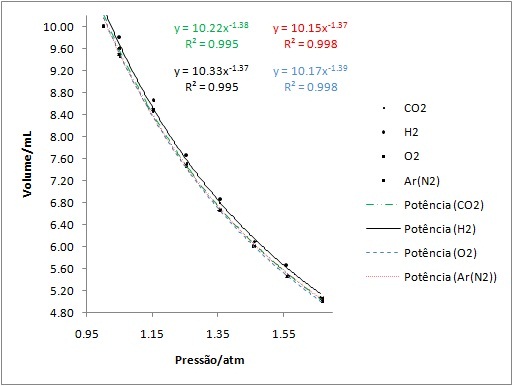
Variação do volume (mL) frente a diferentes pressões
(atm) para as substâncias gasosas: oxigênio,
Hidrogênio, gás carbônico e ar (nitrogênio).
CONCLUSÕES: Neste trabalho foi apresentado um experimento capaz de mostrar ao aluno que gases
diferentes possuem o mesmo comportamento quando nas mesmas condições de
temperatura, pressão e volume. A partir dessa constatação pode-se estabelecer o
quão é insignificante a influência do tamanho molecular em relação ao volume de um
sistema gasoso à pressões ordinárias. Além disso, o experimento foi conduzido a
partir de um aparato desenvolvido com materiais de baixo custo o que favorece e
democratiza sua aplicação mesmo em escolas que não dispõe de laboratórios
didáticos.
AGRADECIMENTOS: CNPq, CAPES, FAPERJ, IFF
REFERÊNCIAS BIBLIOGRÁFICA: ANDREU, M. P. AND M. C. P. RECENA (2010). "Influência de um objeto de aprendizagem nas concepções de estudantes do ensino médio sobre ebulição da água." RENOTE 5(2).
BALEN, O. AND P. A. NETZ (2005). "Aplicação da modelagem e simulação no ensino de modelos de sistemas gasosos." Acta Scientiae : revista de Ciências Naturais e Exatas 7(2): 29.
FARIAS, C. S., A. M. BASAGLIA, ET AL. A importância das atividades experimentais no Ensino de Química.In: 1º CONGRESSO PARANAENSE DE EDUCAÇÃO EM QUÍMICA., 2009, Londrina - Pr. Resumos da 1º Congresso Paranaense de Educação Em Química.
KAUTZ, C. H., M. LOVRUDE, ET AL. (1999). Research on student understanding of the ideal gas law.
LUZ JÚNIOR, G. E., S. A. A. SOUSA, ET AL. (2004). "Química Geral experimental: uma nova abordagem didática." Química Nova 27(1): 164-168.
MORTIMER, E. F. (1995). "Concepções atomistas dos estudantes." Química Nova na Escola 1: 23-26.
