ÁREA: Ambiental
TÍTULO: TERMODINÂMICA DA ADSORÇÃO DE CÁDMIO EM ARGISSOLO DO NOROESTE PAULISTA
AUTORES: Cilense, J.A. (IBILCE/UNESP)
RESUMO: Neste trabalho, foi avaliado o comportamento da adsorção de íons de Cd(II) aquosos, em argissolo estéril em função da temperatura por meio das isotermas de adsorção e de seus parâmetros termodinâmicos. Os parâmetros variação de entropia (ΔS), variação de entalpia (ΔH) e variação da energia livre de Gibbs (ΔG) foram calculados pelo gráfico de ln(Kd) vs 1/T. As isotermas de adsorção foram obtidas com os dados experimentais de equilíbrio. Os modelos de Langmuir e Fruendlich foram ajustados aos dados experimentais, tendo o primeiro apresentado os melhores resultados. Os experimentos termodinâmicos foram realizados nas temperaturas de 20, 25, 35, 45 ºC e constatou-se que o processo de adsorção é de natureza física, espontâneo e exotérmico, sendo menos favorável em temperaturas mais altas.
PALAVRAS CHAVES: solo; adsorção; parâmetros termodinâmicos
INTRODUÇÃO: O risco de contaminação do solo por metais-traço tem conduzido pesquisas que possam impedir, ou pelo menos, minimizar os seus efeitos poluidores. Há muitos anos o solo sofre abusos através da atividade antrópica, devido principalmente, a sua grande capacidade de recuperação. A necessidade de análises químicas do solo é importante não só para buscar melhor produtividade como para o controle ambiental. O estudo da adsorção de metais, com base nas isotermas de Langmuir e Freundlich, permite inferir como estes metais se adsorvem aos componentes do solo, podendo prever o quanto será lixiviado e o quanto será biodisponibilizado, sendo possível estabelecer práticas de remediação. Os principais fatores que influenciam o equilíbrio de adsorção são a estrutura porosa, a heterogeneidade e as propriedades químicas superficiais. O fenômeno de adsorção também depende das diferenças entre as propriedades químicas do solvente e adsorvato. A adsorção pode ser definida como o processo de fixação de partículas de uma substância (adsorvato) na superfície de outra substância (adsorvente), é um processo onde há transferência de um ou mais constituintes de uma fase líquida para uma fase sólida, as moléculas do líquido são atraídas para as zonas interfaciais do adsorvente, por forças atrativas existentes (RUTHEVEN, 1984). Este trabalho teve como objetivo o estudo do comportamento da adsorção de cádmio pelo solo estéril da São José do Rio Preto (SP), por meio da utilização dos modelos de isotermas de Langmuir e Freundlich. Os parâmetros termodinâmicos como variação de entalpia (ΔH), variação de entropia (ΔS) e variação da energia livre de Gibbs (ΔG), foram obtidos em soluções com diferentes temperaturas, a partir de dados experimentais calculados aplicados no gráfico de ln(Kd) versus 1/T.
MATERIAL E MÉTODOS: Sacos plásticos; pá reta; espátulas; cadinhos de porcelana; estufa; peneiras; papel de filtro e reagentes de grau P.A. Os equipamentos utilizados neste trabalho foram: Balança analítica, pHmetro digital, Mesa agitadora, Centrífuga, Membrana filtrante 0,45 μm e Espectrofotômetro de absorção atômica por chama, SpectrAA 50B Varian. Amostras de solo foram coletadas da camada superficial (0 – 20 cm), estas foram destorroadas, submetidas à secagem ao ar e passadas em peneira de 2,00 mm de malha (terra fina seca ao ar - TFSA) conforme descrito em Silva (1999).
A partir do sal de cloreto de Cádmio foi preparada uma solução de 500 ppm que foi usada para diluição das soluções de adsorbato nas concentrações desejadas. Para o estudo de adsorção, pesou-se frações de 2,000 g de solo em erlenmeyers de polipropileno, adicionou-se 20,0 mL de solução de NaCl 0,01 mol/L, contendo cloreto de cádmio em concentrações variando de 2,0 a 150,0 mg/L. As soluções foram submetidas à agitação constante em mesa agitadora a 200 rpm por 1 hora. Em seguida, as amostras foram centrifugadas por 5 minutos a 2800 rpm, filtradas em membrana filtrante de 0,45 μm, coletando-se os filtrados em frascos plásticos (LAIR et al, 2006). A quantidade de metal na solução foi determinada utilizando-se espectrofotômetro de absorção atômica em comprimento de onda, 228,8 nm, específico para o metal, as determinações foram realizadas em duplicata. Trataram-se os dados empregando as isotermas linearizadas de Langmuir e Freundlich. Para efetuar o estudo termodinâmico estes ensaios foram realizados em quatro temperaturas diferentes (20, 25, 35 e 45 ºC).
RESULTADOS E DISCUSSÃO: O solo é arenoso, rico em matéria orgânica, de acidez média e alta acidez trocável. Para a adsorção do metal Cd(II) ao solo, determinou-se a quantidade de metal adsorvido (Cads) por: Cads = (Ci – Ceq)x DF, com Ci a concentração inicial do metal (mg/L) e Ceq a concentração final do metal (mg/L) em solução, DF o fator de diluição igual a 10.
A determinação dos parâmetros termodinâmicos, entalpia (ΔH), entropia (ΔS) e energia livre de Gibbs (ΔG), foram determinados e avaliados usando as equações termodinâmicas: ΔG= -RTlnKd , ln(Kd) = -ΔG/RT = ΔS/R - ΔH/RT, em que: Kd = coeficiente de distribuição do adsorbato (L/g); T = temperatura (K); R = 8,314 J/K mol. O gráfico de ln(Kd) versus 1/T deve ser linear, com inclinação da reta igual a -ΔH/R, e coeficiente linear igual a ΔS/R. A variação da energia livre de Gibbs (ΔG) é o critério fundamental de espontaneidade do processo. Os modelos de Langmuir e Freundlich foram ajustados aos dados experimentais empregando o as equações linearizadas das isotermas. Os coeficientes de regressão estão apresentados na Tabela 1.
De acordo com o coeficiente de correlação dos modelos utilizados (Tabela 1), observa-se que o de Langmuir (BARROS, 2004) se adequou melhor às concentrações de Cd(II) adsorvido. Estudo termodinâmico: Para verificar o efeito da temperatura na adsorção os parâmetros termodinâmicos foram obtidos a partir do gráfico de lnKd versus 1/T (Figura 1). Os parâmetros termodinâmicos encontram-se na Tabela 2.
O valor de ΔH negativo indica que a adsorção de Cd(II) no solo é um processo exotérmico. Nas temperaturas estudadas, os valores negativos de ΔG mostram que o processo de adsorção é favorável termodinamicamente e que as interações solo-Cd(II) ocorreram de forma espontânea.
Tabela 1
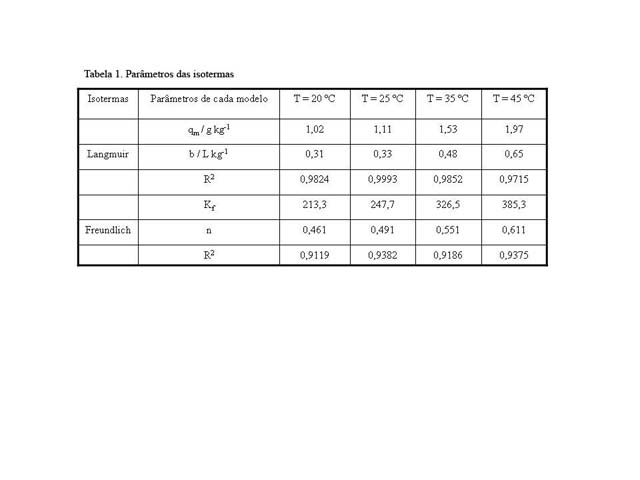
A Tabela 1 resume os valores das constantes das isotermas de Langmuir e Freundlich nas 4 temperaturas analisadas.
Figura 1 e Tabela 2

Trata a Figuta 1 do gráfico de lnKd versus 1/T para a determinação dos parâmetros termodinâmicos da adsorção, os quais estão dispostos na Tabela 2.
CONCLUSÕES: Os dados experimentais ajustaram-se satisfatoriamente ao modelo de Langmuir. O estudo termodinâmico indicou que o processo de adsorção é exotérmico e as interações solo-Cd ocorreram de forma espontânea. O valor de ΔH, menor que 40 kJ/mol, indica que o processo é de natureza física. A ΔS está relacionada às variações de ordem-desordem de um sistema, valores negativos de ΔS sugerem a redução da aleatoriedade na interface sólido-solução durante a adsorção. Observou-se que ΔG diminui com o aumento da temperatura, mostrando que o processo de adsorção é menos favorável em temperaturas mais altas.
AGRADECIMENTOS:
REFERÊNCIAS BIBLIOGRÁFICA: BARROS, M. A. S. D.; ARROYO, P. A. CAPÍTULO V. 2004. Métodos de Remoção de Cromo de Águas Residuais-Métodos de Adsorção. Departamento de Engenharia Química Maringá, Maringá-PR.
LAIR, G. J.; GERZABEK, M. H.; HABERHAUER, G.; JAKUSCH, M.; KIRCHMANN H. 2006. Response of the sorption behavior of Cu, Cd and Zn to different soil management. J. Plant Nutr. Soil Sci., 169: 60-68.
RUTHEVEN, D. M. Principles of Adsorption and Adsorption Processes. 1984. New York: John Wiley & Sons, 433.
SILVA, F. C. 1999. Manual de Análises Químicas de Solos, Plantas e Fertilizantes. Brasília-DF: Embrapa, 369.
