ÁREA: Química Analítica
TÍTULO: Estabelecimento da fase móvel para separação das aflatoxinas B1 e M1 utilizando CLAE-FL
AUTORES: Scaglioni, P.T. (FURG) ; Hackbart, H.C.S. (FURG) ; Pagnussatt, F.A. (FURG) ; Badiale-furlong, E. (FURG)
RESUMO: Neste trabalho foi estabelecida a proporção de fase móvel que possibilita a melhor
separação das AFB1 e AFM1 utilizando-se a cromatografia líquida de alta eficiência
com detector de fluorescência. Para isso partiu-se da fase móvel indicada pela
AOAC para a aflatoxina M1, variando a proporção dos solventes e utilizando os
tempos de retenção das duas aflatoxinas como resposta. A proporção de 55:10:35 de
ácido acético 1 %:acetonitrila:metanol apresentou os tempos de retenção mais
adequados, com um fator de separação de 2,27 entre as AFB1 e AFM1.
PALAVRAS CHAVES: aflatoxina B1; aflatoxina M1,; cromatografia
INTRODUÇÃO: Os métodos de análise devem ser sensíveis e confiáveis o suficiente para serem
utilizados no controle dos limites legislados e também permitir a detecção de
substâncias proibidas presentes por contaminação natural ou intencional,
especialmente para compostos potencialmente genotóxicos ou cancerígenos (RIDGWAY
et al., 2007). A cromatografia líquida de alta eficiência com detecção de
fluorescência (CLAE-FL) é uma técnica bastante utilizada para a separação,
detecção e quantificação de aflatoxinas, incluindo a AFM1 em extrato de leite
(SOUZA et al., 2003) e de AFB1 em cereais (KWIATKOWSKI e ALVES, 2007). Para o
emprego da técnica que determina simultaneamente as AFB1, B2, G1, G2 e M1 é
necessário o estabelecimento das condições cromatográficas, em especial da fase
móvel usando colunas de fase reversa, determinante para a eficiência do método
completo. Neste caso um dos indicativos para a definição da melhor condição é a
determinação do fator de resolução cromatográfica.
As principais aflatoxinas, contaminantes naturais mais frequentes em produtos
agrícolas, são as aflatoxina B1 (AFB1); B2 (AFB2); G1 (AFG1); G2 (AFG2). Entre
os derivados das primeiras estão as aflatoxinas M1 (AFM1) e M2 (AFM2), que são
metabólitos hidroxilados das AFB1 e AFB2 e podem ser encontrados em produtos
lácteos obtidos de animais que ingeriram ração contaminada (CREPPY, 2002). No
entanto, níveis elevados de contaminação com AFB1 e B2 podem resultar em
excreção destas sem metabolização.
Este trabalho consistiu em estabelecer a proporção de fase móvel que possibilita
a melhor separação das AFB1 e AFM1, tendo o fator de separação como indicativo
de eficiência, além de outros parâmetros de validação, visando minimizar a
geração de resíduos ao final da determinação.
MATERIAL E MÉTODOS: Os padrões de AFB1 e AFM1 foram adquiridos da Sigma Chemical Company, 1 mg de
AFB1 foi ressuspenso em 100 mL de benzeno:acetonitrila (98:2), resultando numa
solução de 10 µg mL-1, e 10 µg de AFM1 foram ressuspensos em 10 mL da mesma
proporção de solventes, resultando numa solução de 1 µg mL-1.
Utilizando a CLAE-FL, foi determinada a fase móvel que melhor separou as duas
aflatoxinas, tendo como base o estabelecido pela AOAC (2000), ácido acético 1
%:acetonitrila:metanol (40:35:25). A corrida foi realizada à 35°C, com vazão de
1,0 mL min-1 e detector de fluorescência nos λexcitação = 360 nm e λemissão =
450 nm.
Retirou-se uma alíquota de 50 µL da solução contendo 10 µg mL-1 de AFB1, esse
volume foi seco sob N2, obtendo-se uma massa da micotoxina de 0,5 µg, logo, esta
foi ressuspensa em 1 mL da mesma mistura que compôs a fase móvel de cada caso,
resultando em uma concentração de 0,5 µg mL-1 de AFB1. Semelhantemente, foram
obtidas soluções de 0,1 µg mL-1 de AFM1 e de 0,01 e 0,05 µg mL-1 da mistura das
duas aflatoxinas. Estas soluções foram injetadas na coluna cromatográfica
(Kromasil C18 5μ 250x4,6mm), com alça de injeção com loop de 20 µL.
O limite de detecção foi estabelecido pela injeção de soluções de concentrações
conhecidas e decrescentes de ambas as aflatoxinas, até o menor nível detectável,
com base na relação de três vezes o ruído da linha de base (ANVISA, 2003).
O fator de retenção (k) foi calculado pela razão entre o tempo de
retenção corrigido de cada uma das aflatoxinas e o tempo morto. E o fator de
separação (α) foi determinado pela razão kA/kB, sabendo que o soluto B fica mais
retido na coluna que o A (SOARES, 2006).
RESULTADOS E DISCUSSÃO: Visando a melhor separação das AFB1 e AFM1 e a obtenção de um tempo de retenção
adequado, foram testadas diferentes proporções da fase móvel, descritas na
Tabela 1, assim como o fator de retenção, que indica a relação entre o tempo
que cada micotoxina esteve retida na fase estacionária e o tempo que esteve
sendo carregada pela fase móvel, e o fator de separação, que indica a
seletividade do sistema cromatográfico com relação as duas micotoxinas que eluem
em picos adjacentes, ambos estimados para as diferentes condições.
A mistura do Teste 3 apresentou os tempos de retenção mais afastados do início
da corrida, diminuindo o risco de interferência da matriz e possibilitando um
tempo total de corrida igual a 15 min. Neste teste ocorreu o maior fator de
separação, indicando que os picos se apresentaram o mais distante possível um do
outro, garantindo a melhor seletividade dentre os testes realizados e num
intervalo suficientemente pequeno para não resultar em alargamento dos picos. A
Figura 1 mostra o cromatograma nos limites de detecção das duas aflatoxinas, que
foi determinado como sendo 0,0015 µg mL-1 para ambas micotoxinas.
Tabela 1
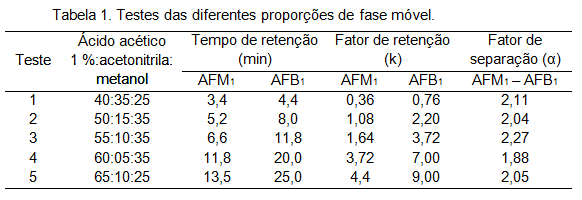
Figura 1

Cromatograma dos limites de detecção das AFM1 (6,723
min) e AFB1 (11,987 min).
CONCLUSÕES: Foi determinada a proporção de fase móvel que resultou na melhor separação das
AFB1 e AFM1, sendo esta igual a 55:10:35 de ácido acético 1 %:acetonitrila:
metanol, com um fator de separação de 2,27 entre as AFB1 e AFM1.
AGRADECIMENTOS:
REFERÊNCIAS BIBLIOGRÁFICA: ANVISA - Agência Nacional de Vigilância Sanitária. 2003. Resolução RE nº 899, de
29/05/2003. Retrieved from: http://www.anvisa.gov.br/legis/resol/2003/re/899_03re.htm
AOAC - Association of Official Analytical Chemists. 2000. Official Methods of analysis international, 17th, CD-ROM, Willian Horwitz.
CREPPY, E. E. 2002. Update of survery, regulation and toxic effects of mycotoxins in Europe. Toxicology Letters, 127: 19-28.
KWIATKOWSKI, A.; ALVES, A. P. F. 2007. Importância da detecção e do controle de aflatoxinas em alimentos. Revista de Saúde e Biologia, 2: 44-53.
RIDGWAY, K.; LALLJIE, S. P. D.; SMITH, R. M. 2007. Sample preparation techniques for determination of trace residues and contaminants in foods. Journal of Chromatography A, 1153: 36-53.
SOARES, L. V. Curso básico de instrumentação para analistas de alimentos e fármacos. 2003. Ed. Manole Ltda., Baueri-SP.
SOUZA, S. V. C.; VARGAS, E. A.; CASTRO, L.; JUNQUEIRA, R. G. 2003. Validação intralaboratorial de método para determinação de aflatoxina M1 em leite por Cromatografia em Camada Delgada. Ciência e Tecnologia de Alimentos, 23: 213-220.
