ÁREA: Química Analítica
TÍTULO: Estudo do comportamento térmico dos oxamatos de Tm(III) e Yb(III)
AUTORES: Caires, F.J. (UNESP) ; Lima, L.S. (UNESP) ; Gomes, D.J.C. (UNESP) ; Gigante, A.C. (UNESP) ; Ionashiro, M. (UNESP)
RESUMO: Sínteses dos oxamatos de túlio(III) e itérbio(III) foram realizadas e o estudo do
comportamento térmico desses compostos foi investigado empregando
termogravimetria e calorimetria exploratória diferencial simultânea acoplado ao
espectrômetro de FTIR (TG-DSC/FTIR).
PALAVRAS CHAVES: oxamato; lantanídeos; comportamento térmico
INTRODUÇÃO: O ácido oxâmico, NH2COCOOH, é bem conhecido como sendo um versátil ligante,
podendo se coordenar a íons metálicos através de ambos os átomos de oxigênio ou
um nitrogênio ou um oxigênio, desta forma tendo a possibilidade de atuar como
bidentado, tridentado ou tetradentado (ligando em ponte) em relação ao número de
coordenação e, também, como mono ou diânion em relação à carga. Vários sais e
complexos de oxamato têm sido sintetizados no estado sólido e investigados
usando técnicas termoanalíticas, difratometria de raios X, espectroscopia de
infravermelho etc. Os trabalhos referem-se ao estudo dos espectros de
infravermelho e eletrônicos de ácido oxâmico e do ácido oxâmico deuterado no
estado sólido, complexos de ácido oxâmico e alguns compostos de íons metálicos
(Wallace et al., 1978; Perlepes et al., 1980; Shoeters et al.,1983), seguidos
por estudos térmicos e magnéticos de compostos de ácido oxâmico
com alguns íons metálicos (Allan et al., 1993; Vansant et al., 1995; Keuleers et
al., 1998) e sínteses, estrutura de cristais, propriedades espectroscópicas e
magnéticas do composto de manganês(II) contendo oxamato e moléculas de água como
ligantes (Rodrigues-Martim et al., 2001). Não há estudos similares de íons
lantanídeos (III) com ácido oxâmico, e os poucos trabalhos publicados referem-se
à preparação, medidas condutométricas, momentos magnéticos e dados espectrais de
alguns complexos de ácido oxâmico (Perlepes et al., 1981), sínteses e estrutura
de raios X de um polímero de praseodímio (oxamato) (Veltsistas et al., 1995) e
sínteses, propriedades físicas e estudos espectroscópicos de complexos de
oxamato de lantanídeos(III)(Lazaridou et al., 1990).
MATERIAL E MÉTODOS: Os carbonatos básicos de lantanídeos foram preparados como já descrito
anteriormente (D’assunção et al., 1980).
Os compostos de Tm(III) e Yb(III), no estado sólido, foram preparados misturando
os respectivos carbonatos básicos de lantanídeos, mantidos em suspensão aquosa,
com ácido oxâmico em ligeiro excesso. As suspensões aquosas foram aquecidas
lentamente até próximo da ebulição até total neutralização do ácido. O carbonato
básico em excesso foi removido por filtração e as soluções aquosas dos
respectivos oxamatos foram evaporadas à secura em banho-maria. Os compostos
depois de secos foram mantidos em dessecador contendo cloreto de cálcio anidro.
As curvas TG-DSC simultâneas foram obtidas no equipamento TG/DSC 1, Stare System
da
Mettler-Toledo. As análises das amostras foram realizadas no intervalo de 30 –
1000 ºC, razão de aquecimento de 10 ºC min-1, atmosfera de ar seco, com fluxo de
50 mL min-1, cadinhos de α-alumina e massa da amostra da ordem de 7 mg. A
identificação dos produtos gasosos liberados na decomposição térmica foi
realizada no equipamento TG-DSC da METTLER TOLEDO acoplado a um
espectrofotômetro Nicolet (FTIR) com célula de gás e detector DTGS KBr. O forno
e a célula aquecida (250 ºC) foram acoplados através de uma linha de
transferência aquecida (200 ºC) de aço inoxidável de 120 cm de comprimento e 2
mm de diâmetro, ambos purgados com ar seco (50 ml min-1). Os espectros de FTIR
foram registrados com 16 varreduras por espectro com resolução de 4 cm-1.
RESULTADOS E DISCUSSÃO: As curvas TG-DSC dos oxamatos de Tm de Yb são mostradas nas Figuras 1(a) e 1(b),
respectivamente.
As curvas TG-DSC mostram quatro etapas consecutivas e sobrepostas de perdas de
massa e eventos térmicos correspondentes a essas perdas. A primeira perda de
massa ocorre entre 90-205 (Tm) e 100-210 °C (Yb), correspondendo a dois picos
endotérmicos em 128 e 167°C com ombro em 189°C (Tm) e três picos endotérmicos em
141, 165 e 210°C (Yb) nas curvas DSC, é atribuída à desidratação com perda de 2
H2O (Tm) e 2,5 H2O (Yb) (Calc=7,68% (Tm) e 9,34% (Yb); TG=7,15% (Tm) e 9,18%
(Yb)).
A decomposição térmica dos compostos anidros ocorre em três etapas consecutivas
e sobrepostas entre 210-630°C (Tm) e 210-600°C (Yb). A primeira etapa entre 210-
365°C (Tm) e 210-360°C (Yb), com perdas de 26,91% (Tm) e 9,18% (Yb),
correspondendo a picos endotérmicos em 294 e 337°C (Tm) e 297 e 334°C (Yb) na
curva DSC é atribuída a pirólise parcial do ligante com liberação de amônia, CO2
e CO como principais produtos (Fig. 2). A segunda etapa entre 365-470°C (Tm) e
360-460°C (Yb) com perdas de 20,04 e 19,41%, respectivamente, correspondendo a
picos endo e exotérmicos em 401 e 442°C (Tm) e 397 e 435°C (Yb) na curva DSC, é
atribuída à decomposição da matéria orgânica, tendo como principais produtos
gasosos NH3, CO, CO2, HCN e HCOHN2 (Fig. 2). A última etapa entre 470-630ºC
(Tm) e 460-600ºC (Yb) com perdas de 4,27% (Tm) e 3,68% (Yb), respectivamente,
correspondendo ao pico exotérmico em 614 ºC (Tm) e 589 ºC (Yb) na curva DSC, é
atribuída à oxidação dos resíduos carbonáceos com liberação CO2 (Fig. 2). A
perda de massa até 630°C (Tm) e 600ºC (Yb) está de acordo com a formação de
Tm2O3 e Yb2O2, respectivamente, como resíduo final (Calc=58,87% (Tm), 59,14%
(Yb); TG=58,83% (Tm), 59,49% (Yb)).
Figura 1.

Curvas TG-DSC simultânea dos compostos em
atmosfera dinâmica de ar:
(a) Tm(L)3∙2H2O(m = 7,022 mg) e (b) Yb(L)3∙2,5H2O
(7,104 mg).
Figura 2.
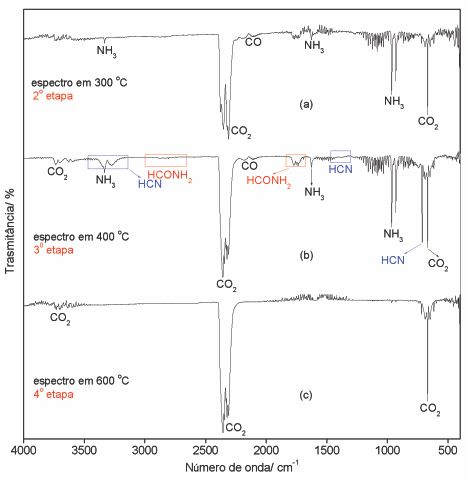
Espectros de infravermelho dos produtos liberados
durante a decomposição térmica dos oxamatos de
Tm(III) e Yb(III) em atmosfera de ar.
CONCLUSÕES: Os resultados das curvas TG-DSC forneceram informações sobre a estequiometria
(Tm(NH2C2O)3•2H2O e Yb(NH2C2O)3•2,5H2O), desidratação, estabilidade, decomposição
térmica e identificação dos produtos gasosos liberados em cada etapa da
decomposição térmica dos oxamatos de túlio e itébio.
AGRADECIMENTOS: Os autores agradecem as fundações FAPESP, CNPq e CAPES pelo apoio financeiro.
REFERÊNCIAS BIBLIOGRÁFICA: ALLAN, JR; DALRYMPLE, J. 1993. The thermal, spectral and magnetic studies of oxamic acid compounds of cobalt(II), nickel(II) and copper(II) ions. Thermochim Acta, 221: 199-204.
D’ASSUNÇÃO, ML; GIOLITO, I; IONASHIRO, M. 1989. Thermal decomposition of the hydrated basic carbonates of lanthanides and yttrium. Thermochim Acta, 137: 319-330.
LAZARIDOU, V; PERLEPES, SP; TSANGARIS, JM; ZAFIROPOULOS, TF. 1990. Synthesis, physical properties and spectroscopic studies of oxamato(1-) lanthanide(III) complexes. J Less-Common Met., 158: 1-14.
KEULEERS, R; JANSSENS, J; DESSEYN, HO. 1998. Thermal analysis of oxamates, thiooxamates and their complexes Part 1. The ligands. Thermochim Acta, 311: 149-154.
PERLEPES, SP; ZAFIROPOULOS, TF; KOUINIS, JK; GALINOS, AG. 1980. Complexes of zinc-group metals with oxamic acid. Chem Letters, 16: 475-480.
PERLEPES, SP; ZAFIROPOULOS, TF; KOUINIS, JK; GALINOS, AG. 1981. Lanthanide(III) complexes of oxamic acid. Z Naturforsch, 36B: 697-703.
RODRIGUES-MARTIM, Y; RUIZ-PÉREZ, C; GONZÁLES-PLATAS, J; SANCHIS, J; LLORET, F; JULVE, M. 2001. A new eight-coordinate complex of manganese(II): synthesis, crystal structure, spectroscopy and magnetic properties of [Mn(Hoxam)2(H2O)4] (H2oxam_oxamic acid). Inorg Chim Acta, 315: 120-125.
SHOETERS, G; DELEERSNUDER, D; DESSEYN, HO. 1983. The complexes of oxamic acid with Ni(II). Spectrochim Acta, 39A: 71-76.
VANSANT, C; DESSEYN, HO; PERLEPES, SP. 1995. The synthesis, spectroscopic and thermal study of oxamic acid compounds of some metal(II) ions. Transition Met Chem, 20: 454-459.
VELTSISTAS, PG; CHRISTOS, PD; KARAYANNIS, MI; SLAWIN, AMZ; WOOLINS, DJ; WILLIAMS, DJ. 1995. Synthesis and X-ray structure of an (oxamato)praseodymium polymer, [Pr(HNCOCO2)1.5(H2O)3]n•2.75H2O. Polyhedron, 14(9): 1251-53.
WALLACE, F; WAGNER, E. 1978. Infrared and far-infrared spectra of solid oxamic acid, deutero-oxamic acid, and their salts. Spectrochim Acta, 34A: 589-606.
