ÁREA: Físico-Química
TÍTULO: AVALIAÇÃO DA ADSORÇÃO DE COBRE POR QUITOSANA E QUITOSANA DESACETILADA
AUTORES: Rodrigues de Sousa, J. (UEG) ; Santos da Silva, A.B. (UEG) ; Ferreira de Souza, L. (UEG) ; Signini, R. (UEG)
RESUMO: O trabalho consistiu no estudo comparativo da adsorção de íons cobre (II) em
quitosana e quitosana desacetilada. A reação de desacetilação da quitosana foi
empregada nesse estudo. Utilizou-se como caracterização da quitosana o grau de
desacetilação, que foi determinado pela titulação potenciométrica. O
procedimento
de adsorção foi realizado com o contato da quitosana com soluções de cobre (II)
em
agitação até atingir o equilíbrio de adsorção. Através do espectrofotômetro de
absorção atômica determinou-se a concentração de equiíbrio do soluto na solução.
Os dados experimentais obtidos foram estudados e foi observado que a quitosana
desacetilada e quitosana apresentaram capacidade para a adsorção do cobre.
PALAVRAS CHAVES: Quitosana; Cobre; Adsorção
INTRODUÇÃO: A atividade industrial tem contribuído muito para o aumento significativo nas
concentrações de íons metálicos em águas, representando uma importante fonte de
contaminação dos corpos aquáticos. Esses metais possuem uma alta toxicidade ao
ser humano em concentrações inadequadas, podendo causar diversas doenças e
distúrbios(JIMENEZ et al.,2004). Os graves problemas gerados por esses metais,
estimularam as pesquisas nesta área, visando a obtenção de métodos alternativos
de baixo custo e mais eficientes no tratamento de águas e despejos(AGUIAR e
NOVAES, 2002). O processo de adsorção têm sido uma das opções mais estudadas no
tratamento de águas e efluentes. Entretanto, o alto custo dos materiais
encontrados comercialmente inviabiliza o seu largo emprego industrial(COSTA et
al.,2000). Uma alternativa mais eficaz e de baixo custo são os bioadsorventes.
Dentre esses, pode-se destacar a quitosana como um efetivo adsorvente de íons
metálicos. A quitosana é um polissacarídeo biodegradável, hidrofílico e
biocompatível, obtido a partir da desacetilação alcalina da quitina(LEE, SHEN e
SHYU, 2001). Em termos de estrutura química, a quitosana é constituída pelas
unidades 2-amino-2-desoxi-D-glicopiranose e 2-acetamidao-2-desoxi-D
glicopiranose, as quais são unidas por ligações glicosídicas do tipo β(1→4).
Esse biopolímero possui a característica de formar complexos com os íons
metálicos devido à presença de grupos amino e hidroxilas livres. O grau de
desacetilação é uma característica que pode influenciar na capacidade de
adsorção, pois controla a fração de grupos amino livres que podem estar
disponíveis para interagir com íons metálicos em solução(GUIBAL, 2004). O
presente trabalho constitui-se do estudo comparativo da adsorção de íons cobre
(II) em quitosana e quitosana desacetilada.
MATERIAL E MÉTODOS: A quitosana purificada foi obtida a partir da dissolução em Ácido Acético (1%),
seguido da sua precipitação através da adição de hidróxido de amônio. Após, o
precipitado foi lavado com água destilada para atingir a neutralidade. Para a
desacetilação da quitosana, 3 g de quitosana purificada foram dissolvidos em 300
mL de água destilada contendo 2 mL de ácido acético glacial, sob agitação
contínua durante 24 horas. Em seguida, a suspensão foi vertida em uma solução
contendo 20 g de hidróxido de sódio, 0,3 mg de NaBH4 e 80 mL de água destilada,
sob agitação mecânica e à temperatura de 90°C, durante 3 horas. Após esse
período, a solução foi filtrada e o precipitado foi lavado com água destilada
até alcançar a neutralidade e depois com metanol. Para a caracterização,
empregou a titulação potenciométrica em amostras contendo 0,2 g de quitosana
dissolvida em 50 mL de solução de HCl 0,05 mol/ e 150 mL de água destilada. Para
a adsorção de íons cobre em quitosana, foram adicionados 50 mL de soluções de
solução cobre II em torno de 100 mg de quitosana purificada. As suspensões foram
mantidas em um banho Maria termostatizado com agitação durante 6 horas (tempo de
equilíbrio). Após esse período a solução foi filtrada em papel de filtro e
guardada para análise. A massa de quitosana foi mantida fixa variando a
concentração da solução de cobre II, sendo usadas as concentrações: 10 mg/L, 20
mg/L, 50 mg/L, 80 mg/L e 100 mg/L. As análises para a determinação de cobre em
equilíbrio foram realizadas em espectrofotômetro de absorção atômica. Para a
quitosana desacetilada empregou-se o mesmo procedimento da adsorção em quitosana
purificada, porém utilizou-se em torno de 50 mg de quitosana desacetilada e as
concentrações das soluções de Cobre II foram: 20 mg/L, 50 mg/L, 60 mg/L e 70
mg/L.
RESULTADOS E DISCUSSÃO: Na caracterização, a curva da titulação da amostra de quitosana, permitiu a
determinação do grau de desacetilação (%GD).Para a quitosana desacetilada o %GD
foi 81,27% e para a quitosana foi 73,80%. Na análise da adsorção, foi
empregado a isoterma de Langmuir e Freundlich, os
quais foram citados na literatura. Para o modelo de Langmuir, foi empregada a
linearização Ceq/q versus Ceq. A partir dos coeficientes linear e angular da
reta foram determinados os parâmetros KL e qmáx, que correspondem à constante de
Langmuir e à capacidade máxima de adsorção, respectivamente. Para o modelo de
Freundlich, foi empregado o gráfico linear do log q versus log Ceq. A partir dos
coeficientes linear e angular da reta foram determinados parâmetros KF e n, os
quais podem também caracterizar as condições da adsorção. Através dos parâmetros
das isotermas apresentadas, observa-se através do coeficiente de linearidade que
a quitosana desacetilada tem tendência maior para o modelo de Langmuir, isso
corresponde que a adsorção dos íons cobre ocupa apenas um único
sítio(monocamada) da bioadsorvente. Já no caso da quitosana apenas purificada já
apresentou um comportamento distinto, pois esse adsorvente seguiu uma relação
linear maior para a isoterma de Freundlich. Os parâmetros apresentados, tanto
para quitosana purificada como desacetilada,demonstraram que a adsorção de íons
cobre é realmente favorável em relação a estes adsorventes, porém os íons cobre
apresentam maior afinidade pela quitosana purificada. A partir da análise, o
grau de acetilação apresentam influência marcante nas propriedades do
biopolímero. Neste estudo, observou quanto o menor grau de acetilação da
quitosana maior é afinidade do adsorvente pelo adsorvato, assim como maior a
capacidade de adsorção.
Isotermas de adsorção de Langmuir
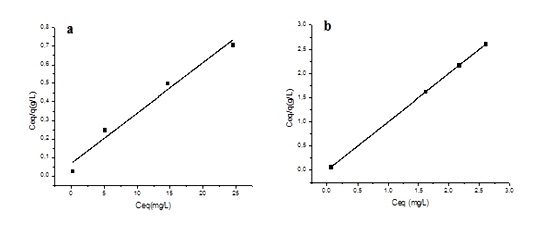
Isotermas de adsorção segundo o modelo de Langmuir:
a) Quitosana Purificada e b) Quitosana desacetilada.
Isotermas de adsorção de Freundlich
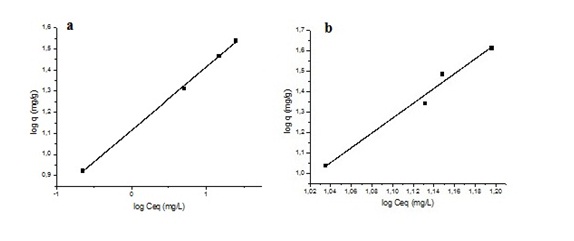
Isotermas de adsorção segundo o modelo de
Freundlich: a) Quitosana Purificada e b) Quitosana
desacetilada.
CONCLUSÕES: A quitosana purificada e a quitosana desacetilada apresentaram uma boa afinidade
com os íons de cobre (II), porém a quitosana purificada apresenta uma maior
afinidade pelo adsorvato, provavelmente devido ao grau de acetilação. Na quitosana
desacetilada verificou que o modelo de Langmuir que descreve o processo de
adsorção , já na quitosana purificada, o modelo encontrado para a adsorção foi o
de Freundlich. A adsorção dos íons nos mostrou grande potencial da quitosana
(purificada ou desacetilada) como bioadsorvente podendo ser empregada para remoção
de cobre e outros metais de efluentes.
AGRADECIMENTOS: Ao CNPq
REFERÊNCIAS BIBLIOGRÁFICA: AGUIAR, M. R. P., NOVAES, A. C. Remoção de metais pesados de efluentes industriais por aluminossilicatos. QUÍMICA NOVA, v. 25, n. 6B, p. 1145-1154, 2002.
COSTA, C. A., SCHNEIDER, I. A., RUBIO, J. Plantas aquáticas secas: uma alternativa moderna para remoção de metais pesados de efluentes industriais. remoção de metais pesados de efluentes industriais. Engenharia Sanitária e Ambiental, v.5, n.1/2, p.19-24, 2000.
GUIBAL, E. Interactions of metal ions chitosan-based sorbents: a review. Separation and Purification Technology, v.38, p.43-74, 2004.
JIMENEZ, R. S., BOSCO, S. M., CARVALHO, W. A. Remoção de metais pesados de efluentes aquosos pela zeólita natural escolecita –influência da temperatura e do ph na adsorção em sistemas monoelementares. QUÍMICA NOVA, v. 27, n. 5, p.734-738, 2004.
LEE, T.S., MI, L.F., SHEN, J.Y., SHYU, S.S. Equilibrium and kinetic studies of copper(II) ion uptake by chitosan tripolyphosphate chelating resin. Polymer, v. 42, p. 1879- 1892, 2001.
