ÁREA: Físico-Química
TÍTULO: Estudo Teórico e Experimental da Formação de Complexo de Inclusão β-Ciclodextrina-Paracetamol
AUTORES: Teixeira, D.A. (IFMT, UNESP.) ; Maciel, E.N. (UFMT) ; Silva, S.C. (UFMT) ; Junior, N.P.S. (FAEMA) ; Gremião, M.P.D. (UNESP) ; Castro, A.D. (UNESP)
RESUMO: A β-ciclodextrina (CD), formada pela união de sete monossacarídeos, é utilizado na formação de complexos de inclusão com o objetivo de aumentar a solubilidade, estabilidade e biodisponibilidade de diversos compostos químicos com propriedades farmacológicas. O paracetamol, pouco solúvel em água e composto de estudo neste trabalho, forma um complexo com a β-ciclodextrina e pode ser condicionada em forma de comprimidos tendo como veículo o amido de milho, sendo desta forma, aumentada a solubilidade do paracetamol para aproximadamente 50%. O estudo teórico, via métodos quânticos semi-empíricos, PM6, demonstra a forma de interação, orbitais moleculares, ligações de hidrogênio e configurações espaciais entre os dois compostos, o que corrobora a formação do complexo de inclusão.
PALAVRAS CHAVES: Ciclodextrina; paracetamol; semi-empírico PM6
INTRODUÇÃO: O presente trabalho estuda a inclusão do paracetamol ou acetaminofeno na cavidade da β-ciclodextrina, esta existe na forma α, β e γ, o que corresponde a 6, 7 e 8 moléculas de monossacarídeos, As modificações químicas das CDs podem possibilitar o aumento da capacidade de inclusão (UEKAMA, 1982). O paracetamol tem propriedades analgésicas e é administrado aos pacientes em forma de cápsulas, comprimidos, gotas e xaropes, apesar do seu grande uso na atualidade, a sua solubilidade é muito baixa.
O desenvolvimento computacional e o aperfeiçoamento de métodos teóricos, possibilitam hoje, um estudo consistente de interações moleculares. A partir deste novo paradigma, a química quântica deixou de ser uma técnica dominada apenas por ultra-especialistas, tornando-se uma ferramenta acessível a físicos e químicos experimentais. Deste modo a modelagem molecular tornou-se uma ferramenta importante de auxílio na interpretação de resultados experimentais e na previsão de propriedades difíceis de serem medidas experimentalmente. Das várias propriedades possíveis de serem previstas pode-se citar cálculos de calor de formação de uma molécula, otimização de estrutura molecular, reatividade, sítio ativo, orbitais moleculares entre outros (Lewars, 2004). Em síntese, o auxilio obtido por cálculos teórico-quânticos minimiza o tempo gasto por pesquisas experimentais.
MATERIAL E MÉTODOS: O trabalho desenvolvido é divido em experimental (procedimentos analíticos e técnicas farmaceuticas) e teórico (método semí-empírico, PM6).
Experimental. A partir de uma solução aquosa de paracetamol na concentração de 50μg/ml, foram preparadas diluições para obter soluções de concentrações de 2,5; 5,0; 7,5; 10,0; 12,5 e 15,0μg/ml. Colocaram-se 2,0 ml das soluções em uma cubeta de quartzo e as leituras das absorvâncias foram realizadas em espectrofotômetro em comprimento de onda 243 nm. Elaborou-se um gráfico relacionando as absorvâncias com a concentração de paracetamol.
O método para avaliação da solubilidade de fases descrito por Higuchi e Connors (1965), é fundamentado nas alterações de solubilidade da molécula-hóspede por adição de CD. Excesso de paracetamol foi adicionado a concentrações variadas de CD de 0 até 16mM, que corresponde a solubilidade aquosa da mesma. Os frascos foram lacrados, protegidos da luz e submetidos à agitação constante sob temperatura controlada de 25ºC, por 48 h. Finalizada a agitação, as amostras foram centrifugadas a 3.000 rpm por 15 minutos em Centrífuga Du Pont ® Sorvall TC 6, filtradas em membrana de acetato de celulose (0,45μm) e a concentração do paracetamol determinada por espectrometria na região do UV.
Teórico. Construção da estrutura molecular da β-ciclodextrina e Paracetamol no programa GaussView e otimizado a estrutura no programa Gaussian03, através do método semi-empírico, PM6 (figura 1). Foi realizado cálculos de orbitais moleculares, e observado as interações entre os dois compostos. Formado o complexo, foi feito a retirada do paracetamol de dentro da cavidade para observação das interações na saída.
RESULTADOS E DISCUSSÃO: A solubilidade do complexo formada pode ser vista na figura 1, na qual se apresentada uma isoterma de solubilidade, sendo evidente o aumento da concentração de paracetamol em água com o concomitante aumento da concentração de β-CD, indicando que as moléculas estão interagindo. Baseado nos dados da literatura, o aumento da solubilidade do paracetamol foi verificado até valores próximos ao limite de solubilidade da β-CD em água, que é de cerca de 16mM (FROMMING e SZEJTLI, 1994).
Em nível teórico ficou evidenciado energeticamente a formação do complexo de inclusão, a energia abaixa consideralvente, figura 2. Quando formado o complexo, há a formação de duas ligações de hidrogênio, uma feita entre a hidroxila na extremidade do paracetamol, e a outra pelo oxigênio da outra extremidade, as ligações são fortes, a ponto de praticamente sofrer ionização o paracetamol. A saída do paracetamol envolve uma energia de ativação por volta de 18 Kcal/mol, e chega a calsar deformação na estrutura ciclodextrina, isso se deve as interações entre os átomos de oxigênio, nitrogênio e hidrogênio, principalmente. Em termos de concentração é possível afirmar que há uma proporção de 1CD:1Paracetamol, devido ao tamanho da cavidade e a interação forte entre o complexo formado. A β-ciclodextrina apresenta uma cavidade, que de um lado é hidrófoba (PSZCZOLA, 1988), e por essa cavidade o paracetamol interage pela extremidade do oxigênio.
Figura 1

Isoterma de adsorção e estrutura 2D e 3D da formação do complexo de inclusão β-CD-Paracetamol.
Figura 2
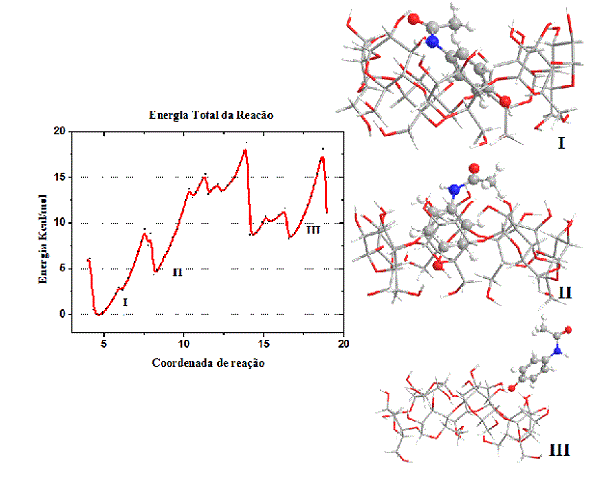
Energia de afastamento dos compostos e configuração espacial.
CONCLUSÕES: O processo experimental que envolve a incorporação da dispersão líquida de β-CD/paracetamol em excipientes, obtenção do granulado e secagem em leito estático (estufa), tanto o amido e a celulose são os excipientes que possibilitariam a incorporação de quantidade maior de fármaco.
A incorporação do paracetamol pela ciclodextrina, dímero, é feita na proporção de 1:1, sendo as interações entre os dois compostos via ligações de hidrogênio. Os dímeros tem interações entre sí devido aos átomos eletronegativos.
AGRADECIMENTOS: IFMT, UFMT e UNESP.
REFERÊNCIAS BIBLIOGRÁFICA: FROMMING, K. Cyclodextrins in drug formulations. In: BREIMER, D.; SPEISER, P. Topics in pharmaceutical sciences. London: Elsevier, 1987. p. 169-80.
PSZCZOLA, D. E. Production and potencial food applications of cyclodextrines. Food Technol., v. 42, p. 96-100,1988.
Lewars, E. (2004). Computational Chemistry. Introduction to the theory and
applications and quantum mechanics. New York: Kluwer Academic Publishers.
Stewart, J. J. P. Computational Chemistry, Version 7.127W web:
HTTP://OpenMOPAC.net
HIGUCHI, T.; CONNORS, K. Phase-solubility techniques. Adv. Anal. Chem. Instr., v. 4, p. 117-212, 1965.
UEKAMA, K. Inclusion complexation of steroid hormones with cyclodextrins in water and solid phase. Int. J. Pharm., v. 10, p. 1-15, 1982.
