ÁREA: Físico-Química
TÍTULO: Aplicação de isotermas de adsorção para o estudo de interface líquido-sólido do tensoativo 12-N,N-dietilamino-octadecenoato de sódio (AR1S)
AUTORES: Tavares Gonzaga, T.W. (UFRN) ; Cavalcanti Roberto, E. (UFRN) ; Oliveira Neto, A.W. (UFRN) ; Castro Dantas, T.N. (UFRN) ; Cardozo Fonseca, J.L. (UFRN)
RESUMO: Os tensoativos tem a capacidade de se adsorver em interfaces por isso vêm sendo
amplamente estudados quanto aos seus parâmetros físico-químicos. Este trabalho tem
como objetivo fazer o estudo de adsorção em interface líquido-sólido do tensoativo
12-N,N-dietilamino-octadecenoato de sódio (AR1S), variando a salinidade e a
temperatura. As concentrações de NaCl no meio foram de 0,5M e 1,0M e as
temperaturas de 30 ºC e 60 ºC. As medidas foram realizadas no potenciostato MQPG-
01, da Microquímica. Aplicaram-se os modelos de isotermas de adsorção de Langmuir,
Freundlich e Lagmuir-Freundlich, com o objetivo de validar os dados experimentais.
PALAVRAS CHAVES: tensoativo; adsorção; isoterma
INTRODUÇÃO: As moléculas tensoativas se adsorvem em interfaces líquido-líquido, líquido-
sólido e líquido-gás, e por isso vêm sendo amplamente empregados em diversos
sistemas de interfaces físico-químicos. Estas moléculas formam filmes
interfaciais a partir de estruturas de micelares com diferentes estruturas
geométricas, dependendo da concentração micelar crítica (CMC). A adsorção
consiste no acúmulo de partículas sobre uma superfície. O processo de adsorção
pode ser classificado como fisissorção (adsorção física) ou quimissorção
(adsorção química). Na adsorção física as moléculas encontram-se fracamente
ligadas à superfície e a energia de interação apresenta o valor entálpico médio
de 20 kJ.mol-1 (KANDEMIRLI; SAGDINC, 2007). Na adsorção física as interações
entre o adsovato e o adsorvente são mais fortes e o valor entálpico médio é
maior que 25 kJ.mol-1.
Uma vez que todos os processos de adsorção são exotérmicos, a quantidade de
substância adsorvida na superfície decresce com o aumento da temperatura. A
relação entre a quantidade adsorvida e a concentração é conhecida como isoterma
de adsorção.
Neste trabalho se estudou a adsorção em interface líquido-sólido, aplicando o
tensoativo 12-N,N-dietilamino-octadecenoato de sódio (AR1S), variando as
concentrações de salinidade, NaCl a 0,5M e 1,0M, e temperatura, 30°C e 60°. Para
estudar os parâmetros físico-químicos aplicou-se as isotermas de Langmuir,
Freundlich e Lagmuir-Freundlich.
MATERIAL E MÉTODOS: As análises de adsorção em interface líquido-sólido foram realizadas em um
potenciostato MQPG-01. Os ensaios foram realizados em célula clássica de três
eletrodos, onde se utilizou o eletrodo de referência de Ag/AgCl (prata/cloreto
de prata), o contraeletrodo de platina e o eletrodo de trabalho utilizado foi um
eletrodo constituído do aço API5LX Gr X42. Utilizou-se borbulhamento de oxigênio
durante todas as medidas, com o intuito de evitar os efeitos de difusão no seio
da solução.
Após a obtenção dos valores da taxa de adsorção do tensoativo na superfície do
aço, estudou-se a aplicação de modelos de isotermas de adsorção com o objetivo
de validar os dados experimentais. As isotermas aplicadas e estudadas foram as
de Langmuir, Freundlich e Lagmuir-Freundlich.
RESULTADOS E DISCUSSÃO: A Figura 1 mostra as isotermas aplicadas para o estudo de adsorção de interface
líquido-sólido.
A análise da Figura 1 mostra que a isoterma de Langmuir- Freundlich foi a que se
ajustou melhor ao fenômeno de adsorção, o que pode ser observado pela melhor
acomodação da isoterma aos dados experimentais.
A Tabela 1 apresenta os valores dos parâmetros e os valores dos coeficientes de
correlação encontrados para a isoterma de Langmuir-Freundlich e as energias
livre de Gibbs de adsorção.
Analisando os valores dos coeficientes de correlação observa-se que a isoterma
de adsorção de Langmuir-Freundlich se ajustou bem ao processo de adsorção, pois
os valores foram 0,977 e 0,978. Fazendo a análise dos valores das constantes de
adsorção, pode-se observar que quando se aumentam a temperatura e/ou a
concentração de sal no meio há uma diminuição dos valores das constantes de
adsorção, ou seja, a intensidade da atração entre as micelas e a superfície
metálica diminui. Isso porque a adição de eletrólito influencia de forma que a
adsorção dos tensoativos iônicos na superfície metálica opostamente carregada
diminua. O aumento da temperatura também causa decréscimo no percentual de
adsorção quando se trata de tensoativos iônicos (PARIA; KHILAR, 2004). O fator
de heterogeneidade (nLF) é analisado como sendo a acomodação das micelas em
multicamada. Os valores de nLF diminui a medida que se aumenta a temperatura
e/ou a concentração de sal no meio, então podemos dizer que acomodação das
micelas em multicamadas é desfavorecida. O processo de adsorção para os sistemas
estudados é tipicamente físico, pois os valores de ΔGads obtidos foram abaixo de
20 kJ/mol. Observa-se que à 60ºC os ΔGads foram mais negativos. Os valores de
ΔGads são negativos o que indica que o processo de adsorção é espontâneo.
Figura 1
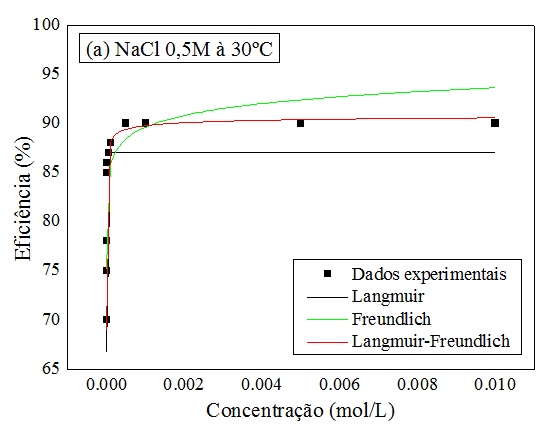
Curvas dos modelos de Langmuir, Freundlich e
Langmuir-Freundlich para o AR1S em NaCl 0,5M e 30ºC
Tabela 1
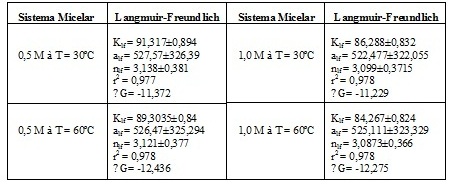
Valores dos parâmetros da isoterma de Langmuir-
Freundlich
CONCLUSÕES: A isoterma de Langmuir-Freundlich foi a isoterma que melhor se ajustou ao processo
de adsorção. Os valores dos parâmetros físico-químicos encontrados mostram que o
processo de adsorção é espontâneo e que a acomodação das micelas ocorre em
multicamada. O aumento da temperatura e/ou da concentração de sal no meio provoca
diminuição da intensidade da atração entre as micelas e a superfície metálica.
AGRADECIMENTOS: Ao PRHPB22, a Capes e ao Laboratório de Tecnologia de Tensoativos do Departamento
de Química da UFRN.
REFERÊNCIAS BIBLIOGRÁFICA: ATKIN, V. S. J. CRAIG E. J. WANLESS, S. BIGGS, Advances in Colloid and Interface Science, 103, 219-304, 2003.
KANDEMIRLI, F., SAGDINC, S. Theoretical study of corrosion inhibition of amides and thiosemicarbazones. Corrosion Science, 49, 5, 2118-2130, 2007.
OSMAN, M. M.; SHALABY, M.N., Materials Chemistry and Physics, 77, 261-269, 2002.
PARIA, S.; KHILAR, K. C. Advances in Colloid and Interface Science, 110, 3, 75- 95, 2004.
ZHANG, P. SOMASUNDARAM, Advances in Colloid and Interface Science, 123-126, 213-229, 2006.
